- Ответы на часто задаваемые вопросы о лазерной эпиляции — VersuaClinic
- Воздействие различных гормонов на волосяные фолликулы
- ВК Клиника пластической хирургии
- Изменения в динамике волосяных фолликулов у женщин
- 1. Введение
- 2. Основные аспекты хронобиологии цикла волос
- 3. Координация между последовательными циклами волос
- 4. Послеродовое выпадение волос
- 5. Волосяные фолликулы во время климактерического периода
- 6. Климактерическое выпадение волос
- 7. Беременность и климактерический гирсутизм на лице
- 8. Заключение
- Благодарности
- Дермальная конденсация волосяного фолликула образуется через выход примированного Fgf20 клеточного цикла, подвижность клеток и агрегацию
- Генерация первичного рисунка волосяных фолликулов
- Как хронический стресс приводит к выпадению волос
- Старение волосяного фолликула происходит за счет трансэпидермального удаления стволовых клеток посредством протеолиза COL17A1
- Микробиом волосяного фолликула пациентов с андрогенной алопецией
- Спросите экспертов: Тестирование волос по сравнению с тестированием волосяного фолликула
Ответы на часто задаваемые вопросы о лазерной эпиляции — VersuaClinic
В настоящее время лазерная эпиляция является самым радикальным способом борьбы с нежелательной растительностью на лице и теле. Данную процедуру клиники красоты предлагают сравнительно недавно, и, как все новое, она вызывает много вопросов. Самые распространенные с комментариями дерматокосметолов VERSUA Clinic мы приводим в этой статье.
Через сколько времени выпадают волосы после лазерной эпиляции?
Ждать сиюсекундного результата не стоит. Во время процедуры луковицы лишь отмирают. Волосы после лазерной эпиляции выпадают быстро — в течение 1-3 дней, но вы, скорее всего, не увидите, как это происходит. Ведь данный процесс не моментальный, а постепенный. То есть вы будете терять волосяные фолликулы во время сна, занятия спортом и т. д.
Обратите внимание:
После лазерной эпиляции выпадает не более 25% волос, находящихся в обработанной зоне. Это объясняется тем, что на воздействие лучом «откликаются» лишь те, которые находятся в стадии роста.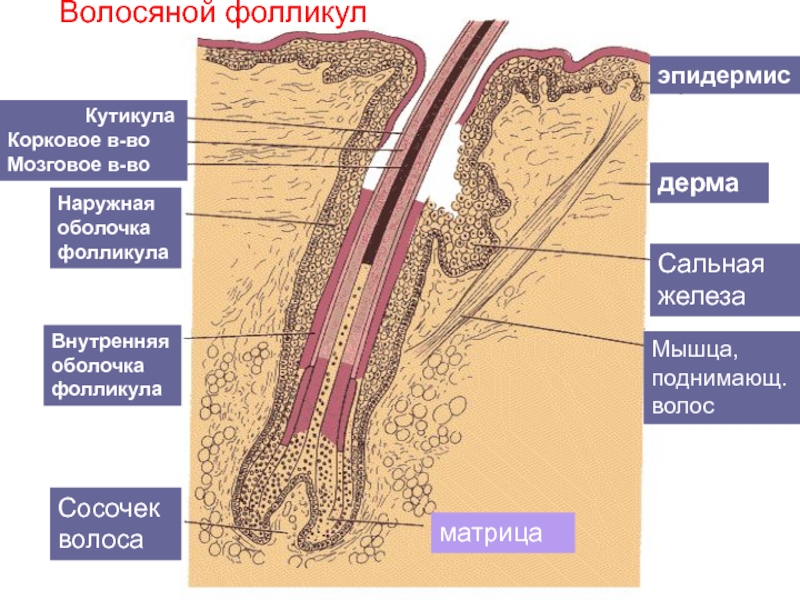
Растут ли волосы после лазерной эпиляции?
Разрушенные фолликулы не восстанавливаются. То есть, они больше не надут о себе знать. После лазерной эпиляции растут лишь волосы, которые находились в стадии покоя и сна. То есть, пройдя жизненный цикл, они начинают его заново. И именно в этот момент следует провести процедуру повторно.
Сколько не растут волосы после лазерной эпиляции?
Как правило, интервал между сеансами составляет 14—20 дней с последующим увеличением, так как каждый раз после процедуры жизненный цикл оставшихся фолликулов замедляется.
Можно ли брить волосы после лазерной эпиляции?
Да. Брить волосы после лазерной эпиляции можно — все зависит от того, раздражает ли вас отросшая между терапевтическими сеансами «растительность» и насколько. Однако есть важный нюанс, который стоит иметь в виду. На процедуру следует приходить, когда длина волос составляет не менее 2 мм. А если к назначенному врачом дню вам пришлось побрить участок тела, подлежащий обработке, то рекомендуем связаться со специалистом — возможно, придется перенести сеанс.
Почему после лазерной эпиляции нельзя выщипывать волосы?
Таким образом вы избавляетесь от луковицы. Правда, не навсегда, а на время. В результате жизненный цикл волос будет нарушен и придется передвинуть проведение сеанса на более поздний срок. Это, в свою очередь, приведет к увеличению количества процедур и, соответственно, к большим материальным затратам. Вот почему после лазерной эпиляции нельзя ни выщипывать волосы, ни избавляться от них воском, шугарингом и другими способами, травмирующими фолликул. Возможно только бритье!
Воздействие различных гормонов на волосяные фолликулы
Последнее обновление:
Наука доказала, что на цикл роста и структуру волосяных фолликулов сильно влияют различные гормоны.
Не секрет, что андрогены – такие как тестостерон, дигидротестостерон и их прогормоны, дегидроэпиандростерона сульфат и андростендион, – ключевые факторы в терминальном росте волос.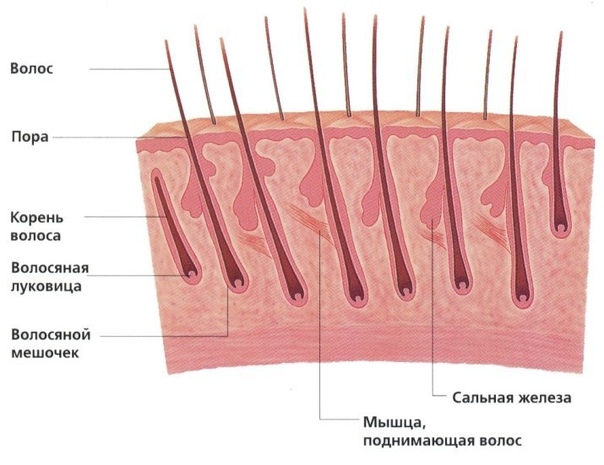
Они воздействуют на специфические (гормонозависимые) участки тела, превращая светлые пушковые волоски в толстые и темные терминальные волосы.
Для этого андрогены связываются с внутриклеточными рецепторами в клетках дермальных сосочков волосяного фолликула. Чтобы этот процесс был «успешным», большинству волосяных фолликулов требуется внутриклеточный фермент 5-альфа-редуктаза для преобразования тестостерона в дигидротестостерон.
Помимо андрогенов, в настоящее время изучается роль и других гормонов. Например, эстрадиол может значительно изменить рост и цикл волосяного фолликула, связываясь с рецепторами эстрогена и влияя на активность фермента ароматазы, который отвечает за преобразование андрогена в эстроген.
Обзор включает в себя обобщенные результаты многих анализов и дает современное понимание влияния гормональных изменений на волосяной фолликул.
Фото с сайта www.shutterstock.com
Как гормоны влияют на рост волос
Волосы – это нитеобразные образования, состоящие в основном из мертвых ороговевших клеток. Структура волоса состоит из двух частей: волосяного фолликула и стержня волоса.
Структура волоса состоит из двух частей: волосяного фолликула и стержня волоса.
Волосяной фолликул можно разделить на верхнюю и нижнюю части. Верхняя часть включает в себя воронку и перешеек, а нижняя часть называется луковицей и супрабульбарной областью.
Волосяная луковица состоит из дермального сосочка (который включает группу специализированных фибробластов, кровеносных капилляров и нервных окончаний) и волосяного матрикса (состоящего из быстро пролиферирующих кератиноцитов).
Фолликулы волос закреплены в подкожной клетчатке и имеют повторяющиеся циклы роста.
Стержень волоса делится на три слоя: кутикулу, кору и мозговое вещество. Медулла – это внешняя часть волоса, которая видна над кожей. Он окружен защитным слоем, который называется корневым влагалищем. Оболочка корня состоит из двух слоев: внутреннего и внешнего.
Цикл волосяного фолликула делится на три основные фазы: анаген, катаген и телоген. Иногда выделяют дополнительную фазу: экзоген (или выпадение).
Иногда выделяют дополнительную фазу: экзоген (или выпадение).
Самая продолжительная фаза – анаген, или фаза роста, которая имеет максимальную продолжительность в 2–7 лет на голове. Во время этой фазы клетки в нижней части волоса активно делятся, а клетки матрикса мигрируют наружу.
Фаза катагена – это короткий переходный период, или регресс. Эта фаза длится около трех недель. Стержень волоса в этот период теряет связь с сосочком и сокращается.
Фазу телогена можно назвать стадией покоя. На голове она может длиться около 3-4 месяцев и характеризуется регрессом матрикса и ретракцией сосочка в область рядом с выпуклостью.
В любой момент времени до 85–90% волос на коже головы остаются в фазе анагена, тогда как остальные фолликулы находятся либо в фазе катагена, либо в фазе телогена. Подробнее
Эндокринная регуляция волосяного фолликула
Андрогены
Андрогены – это половые стероидные гормоны.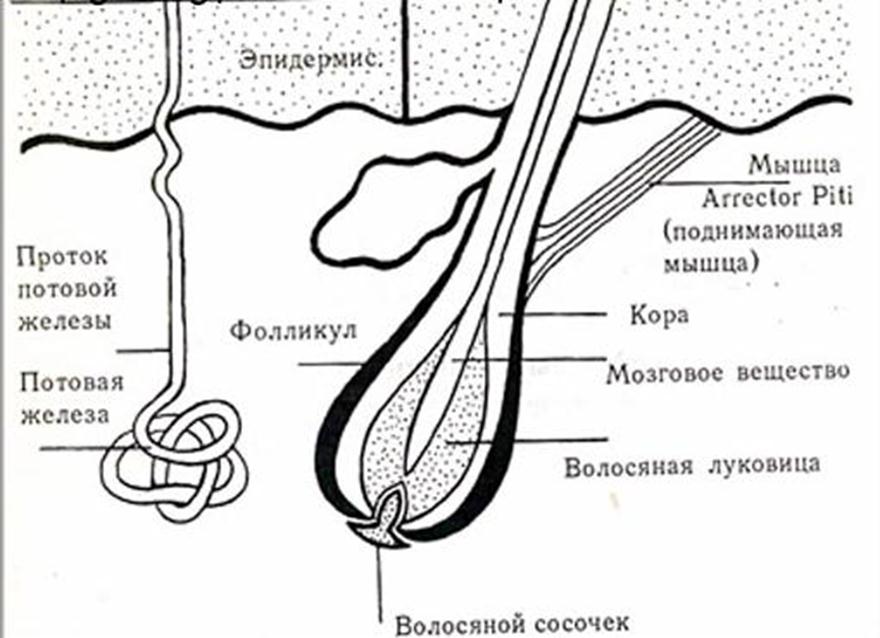 Источниками андрогенов являются надпочечники, гонады (яичники, семенники), мозг и плацента у беременных.
Источниками андрогенов являются надпочечники, гонады (яичники, семенники), мозг и плацента у беременных.
Андрогены осуществляют свое действие через внутриклеточные рецепторы в клетках сосочков дермы.
Выработка тестостерона ограничена семенниками (в период полового созревания) у мужчин и яичниками и корой надпочечников у женщин репродуктивного возраста. У женщин тестостерон в значительных количествах поступает из андростендиона.
Роль андрогенов на рост волос неоспорима, однако их влияние на волосяные фолликулы зависит от расположения волос на теле.
В период полового созревания значительное повышение уровня андрогенов заставляет пушковые волосы в лобковой и подмышечной областях трансформироваться в терминальные.
А на волосяные фолликулы в коже головы андрогены оказывают, напротив, угнетающее действие.
Половые гормоны
Эстрадиол
Эстрадиол может значительно изменить рост и цикл волосяного фолликула.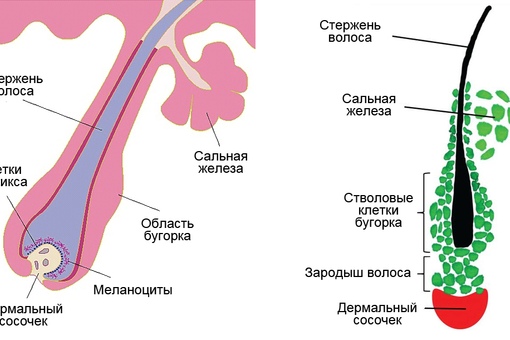
Другое действие эстрадиола связано с его влиянием на метаболизм андрогенов – например, ингибирование активности фермента ароматазы, которая отвечает за превращение андрогена в эстроген.
ПрогестеронПрогестерон может влиять на рост волосяных фолликулов посредством центрального и местного действия.
На уровне волосяного фолликула прогестерон снижает превращение тестостерона в дигидротестостерон (за счет ингибирования активности 5-альфа-редуктазы).
ПролактинПролактин также известен как лютеотропин и представляет собой полипептидный гормон. Его роль в основном связана с ростом молочных желез во время беременности и выработкой грудного молока.
Однако в последнее время многие исследования были сосредоточены на изучении новых функций пролактина, и теперь признано, что он играет роль не только в лактации, но и в репродукции, ангиогенезе, осморегуляции и даже росте волос.
Пролактин признан модулятором метаболизма андрогенов и также, как и прогрестрон, ингибирует активность 5-альфа-редуктазы.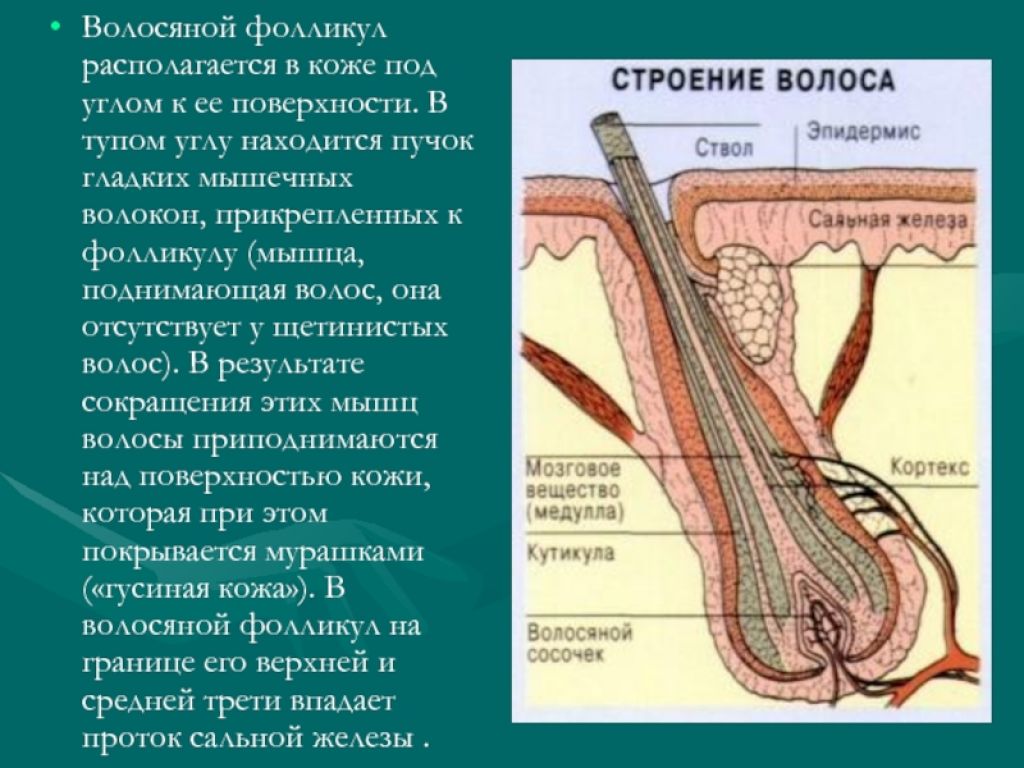
Кожа человека, включая волосяные фолликулы, находится под сильным влиянием оси гипоталамус-гипофиз-щитовидная железа (ось HPT), которая контролирует многие метаболические процессы.
Рецепторы гормонов щитовидной железы могут находиться в соске и во внешней оболочке корня волоса.
Т3 и Т4 могут напрямую влиять на важные функции волосяных фолликулов. Некоторые из этих эффектов включают, помимо прочего, продление фазы анагена.
В связи с тем, что процесс роста волос кажется очень энергоемким, наиболее вероятно, что гормоны оси HPT регулируют энергию метаболизма волосяных фолликулов и функции митохондрий.
МелатонинМелатонин синтезируется в основном шишковидной железой, а также в меньших количествах в коже, сетчатке, костном мозге, пищеварительном тракте, мозге, яичниках и яичках.
Независимо от своего источника, мелатонин выполняет антиоксидантную функцию, улавливая и инактивируя активные формы кислорода и азота, возникающие в результате окислительного стресса.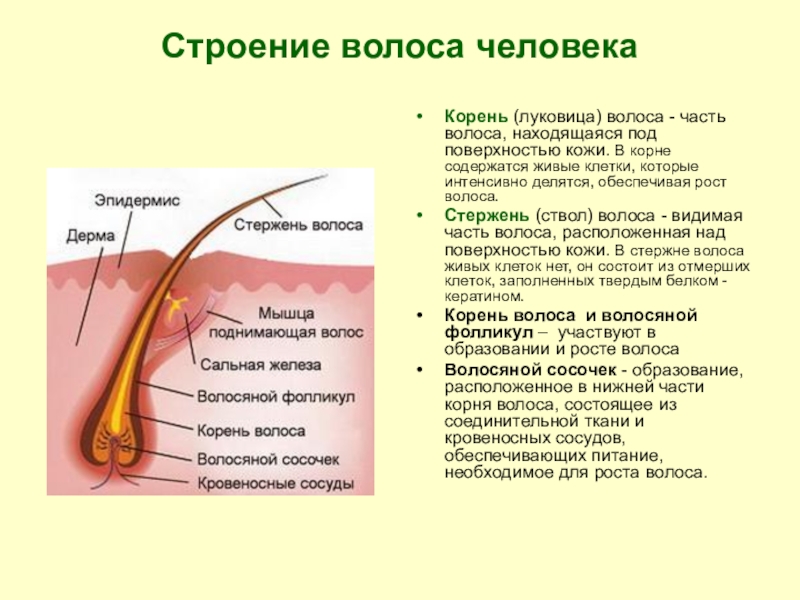
Рецепторы мелатонина находятся не только в клетках волосяных фолликулов, но и в эпидермальных кератиноцитах, дермальных фибробластах, потовых железах и эндотелии кровеносных сосудов.
Мелатонин в основном участвует в пигментации волос, увеличивая количество меланоцитов, а также влияет на их рост, вероятно, за счет стимуляции фазы анагена.
Считается, что мелатонин может прямо и косвенно регулировать рост волос. Однако понимание роли мелатонина в биологии волосяных фолликулов все еще очень ограничено.
Другие гормоны
КРГКортикотропин-рилизинг-гормон (КРГ) секретируется паравентрикулярным ядром гипоталамуса. Это центральная движущая сила гормональной системы стресса.
В коже человека рецепторы КРГ были впервые обнаружены почти четверть века назад.
КРГ признан ингибитором образования стержня волоса, а он также участвует в преждевременной стимуляции фазы катагена.
Гормон также влияет на уменьшение пролиферации кератиноцитов в матриксе волоса и индукцию их апоптоза (или клеточной гибели).
КРГ регулирует рост волос как прямо, так и косвенно, в основном за счет усиления экспрессии гена проопиомеланокортина и его процессинга в фолликулах.
АКТГАдренокортикотропный гормон (АКТГ) вырабатывается передней долей гипофиза, и его секреция регулируется КРГ.
Исследования, проведенные на волосяных фолликулах мышей и норок, предполагают, что АКТГ индуцирует фазу анагена, влияя на метаболизм стероидов в коже.
Роль АКТГ в росте волос человека до сих пор неясна и требует определения.
КортизолКортизол – это стероидный гормон, вырабатываемый надпочечниками. Он играет роль в широком спектре процессов в организме человека. Однако его основная функция – контролировать реакцию организма на стресс.
В последнее время особое внимание уделяется концентрации кортизола в волосах как многообещающему диагностическому инструменту в клинической практике.
Считается, что концентрация кортизола в волосах влияет на их правильный рост.
Высокий уровень кортизола напрямую связан со снижением синтеза и преждевременной деградацией гиалуронанов и протеогликанов – важных модуляторов функции волосяных фолликулов.
В то время как низкий уровень кортизола может положительно влиять на рост волос, замедляя разрушение этих двух компонентов кожи.
ТРГТиротропин-рилизинг-гормон (ТРГ) вырабатывается в гипоталамусе. Ген ТРГ экспрессируется во многих органах человеческого тела, включая волосяной фолликул человека.
ТРГ не только способствует удлинению стержня волоса, но также продлевает фазу роста.
ГаланинГаланин – нейропептид, широко распространенный в центральной и периферической нервной системе.
Этот нейромедиатор признан ингибитором роста волос человека: он уменьшает пролиферацию кератиноцитов матрикса, укорачивает фазу анагена и уменьшает удлинение стержня волоса.
Итак, мы кратко разобрали влияние различных гормонов на рост волос. Ну а в следующей статье разберём гормональное воздействие на волосы на разных этапах жизни женщин.
Статья подготовлена:
Автор: M. Grymowicz, E. Rudnicka, A. Podfigurna, P. Napierala, R. Smolarczyk, K. Smolarczyk, B. Meczekalski – Medical University of Warsaw and Poznan University of Medical Sciences, Poland
Адаптированный перевод: Олеся Смагина, помощник директора центров эпиляции «Вселенная красоты»
Источник:
M. Grymowicz, E. Rudnicka, A. Podfigurna, P. Napierala, R. Smolarczyk, K. Smolarczyk, B. Meczekalsk Hormonal Effects on Hair Follicles. International Journal of Lasers in Molecular Sciences. 2020 Aug; 21(15): 5342.
ВК Клиника пластической хирургии
Что такое Трансплантация волос?
Трансплантация волос – это хирургическая техника, которая включает в себя перемещение волосяных фолликул из одной части тела в другую.
Методы пересадки волос варьируется от расширения кожи головы, чтобы увеличить площадь волос и передать отдельные волосяные фолликулы к привлекательным районам.
Пряди волос, которые были перемещены в другую часть тела того же самого человека продолжают расти естественным образом и с очень небольшим побочным эффектам.
Трансплантация волос
Человеческие волосы растут группами по 1~4 пряди из каждого фолликула, которые называются “фолликулярная единица”.
У 50% корейцев, как правило, растут две пряди из каждого фолликула, 30% растет одна прядь из фолликулы, и три-четыре пряди у 20% населения.
Следовательно, на основе такой особенности волос, делается трансплантация волос по фолликулярной единице в эти же дни.
01
Трансплантация волос
по фолликулярной единице VS по единому волоскуТрансплантация волос по фолликулярной единице
Отбирание пучков фолликулярной единицы без ущерба при имплантации.
1 .
Минимальный ущерб фолликул равно на больше шансов успешного импланта.
2 .
Фолликулярные единицы также приведут фолликулов в покое фразы, которая может увеличить количество волос на 10%.
3 .
Концентрированная имплантация 3-4 пряди приводит к обильному виду волос.
4 .
В одно время побольше фолликулы могут быть имплантированы.
5 .
Пересаженные волосы выглядят естественно растущими.
Трансплантация по единому волоску
Имплантация одного пряди волос, которые отделены от их естественных групп.
Повреждения фолликул во время процесса разделения снижает их живучесть и замедляет рост волос.
Изменения в динамике волосяных фолликулов у женщин
Эндокринные изменения, возникающие после родов и менопаузы, участвуют в контроле выработки кожного сала и модуляции роста волос. Последующие условия включают некоторые специфические аспекты выпадения волос (выпадения волос), алопеции и гирсутизма лица. Цикличность волос имеет большое клиническое значение, поскольку большинство нарушений роста волос возникают в результате нарушений этого хронобиологического признака. Следует отметить, что любая корреляция между биологической аномалией и нарушением круговорота волос не доказывает причинно-следственной связи.Доля женщин в постменопаузе в общей популяции растет. Таким образом, распространенность этих нарушений волосяных фолликулов во всем мире растет. Современные методы лечения направлены на исправление основного гормонального дисбаланса и улучшение общего косметического вида. Однако при отсутствии патогенетического диагноза и критериев причинно-следственной связи шансы на то, что лечение, проводимое по прихоти судьбы, будет адекватно контролировать выпадение волос, малы. Риск и частота терапевтической инерции еще больше увеличиваются.Когда выпадение волос не контролируется и / или не компенсируется ростом новых волос, неумолимо развиваются некоторые клинические аспекты алопеции.
Последующие условия включают некоторые специфические аспекты выпадения волос (выпадения волос), алопеции и гирсутизма лица. Цикличность волос имеет большое клиническое значение, поскольку большинство нарушений роста волос возникают в результате нарушений этого хронобиологического признака. Следует отметить, что любая корреляция между биологической аномалией и нарушением круговорота волос не доказывает причинно-следственной связи.Доля женщин в постменопаузе в общей популяции растет. Таким образом, распространенность этих нарушений волосяных фолликулов во всем мире растет. Современные методы лечения направлены на исправление основного гормонального дисбаланса и улучшение общего косметического вида. Однако при отсутствии патогенетического диагноза и критериев причинно-следственной связи шансы на то, что лечение, проводимое по прихоти судьбы, будет адекватно контролировать выпадение волос, малы. Риск и частота терапевтической инерции еще больше увеличиваются.Когда выпадение волос не контролируется и / или не компенсируется ростом новых волос, неумолимо развиваются некоторые клинические аспекты алопеции. В настоящее время мало доказательств, подтверждающих какое-либо конкретное лечение этих эндокринных заболеваний волос у женщин в послеродовом и постменопаузальном периоде. Современные стратегии лечения волос симптоматичны и неспецифичны, поэтому современные исследователи стремятся разработать новые целевые методы.
В настоящее время мало доказательств, подтверждающих какое-либо конкретное лечение этих эндокринных заболеваний волос у женщин в послеродовом и постменопаузальном периоде. Современные стратегии лечения волос симптоматичны и неспецифичны, поэтому современные исследователи стремятся разработать новые целевые методы.
1. Введение
Волосяной фолликул представляет собой сложный миниорган, состоящий из различных клеточных популяций, характеризующихся их различными местоположениями, функциями и выражениями молекулярных компонентов.Он представляет собой уникальную динамическую систему, претерпевающую непрерывные циклы роста на протяжении всей жизни [1, 2]. Этот миниорган обычно восстанавливается от 8 до 10 раз в течение жизни человека [3]. Циклический процесс трансформации волосяного фолликула происходит под управлением системы осцилляторов, называемых «часами цикла волос». Это происходит одновременно с изменениями в сальных железах, перифолликулярной дерме и подкожной клетчатке [3, 4].
Синхронизированный цикл волос преобладает у большинства млекопитающих, готовящих шерсть к сезонным изменениям окружающей среды.У людей рост волос – это не непрерывный процесс, а последовательный асинхронный ритм, ведущий к периодической регенерации волосяных фолликулов. Причина этого несинхронизированного процесса у человека неясна [5]. Цикл роста волос контролируется различными гормонами и местными факторами роста, которые, вероятно, производятся как внутри, так и рядом с волосяной луковицей и фолликулярным сосочком [6]. Кроме того, незначительные изменения окружающей среды потенциально влияют на биологию волос. Нарушения роста волос объясняются, в основном, нарушениями нормальной динамики цикла роста волос [1, 7].Затем изменяется общая плотность стержней волос [1, 8].
Некоторые клинические последствия нарушения биологии волос зависят от пола. Ряд клинических проявлений весьма специфичен для некоторых периодов жизни женщины. Для каждого из этих состояний патомеханизм выглядит совершенно разным, что позволяет ожидать некоторого прогресса в их лечении в будущем. Этот обзор направлен на повышение осведомленности о проблемах нарушений волос у женщин в послеродовой период и в период менопаузы, а также на обсуждение некоторых вариантов оценки и лечения, относящихся к этой группе женщин.
Этот обзор направлен на повышение осведомленности о проблемах нарушений волос у женщин в послеродовой период и в период менопаузы, а также на обсуждение некоторых вариантов оценки и лечения, относящихся к этой группе женщин.
2. Основные аспекты хронобиологии цикла волос
Очевидно, что у женщин существует широкий спектр жалоб на волосы, но по-прежнему невозможно найти соответствующие эпидемиологические данные в литературе. Рост волос включает уникальный процесс циклической регенерации фолликулов, находящихся в фазах роста и покоя [1, 3, 5, 7, 8]. Последовательность фаз анагена, катагена и телогена следует за повторяющимся периодом, который строго контролируется хронобиологическими синхронизаторами. На продолжительность цикла волос влияют возраст, патология и множество физиологических факторов.Продолжительность фазы анагена любого отдельного волоса составляет от трех до шести лет. Эта фаза роста волос характеризуется интенсивным обновлением клеток, за которым следует окончательное созревание. Он включает эпителиальный рост волосяной луковицы глубоко в дерму с образованием стержня волоса (рис. 1). По завершении этой фазы роста волосяная луковица следует за быстрой инволюцией волосяного фолликула во время фазы катагена. Волосяной фолликул втягивается до средней части волосяного фолликула и переходит в фазу покоя телогена.Около 15-20% волос на коже головы обычно находятся в телогене. В среднем через три месяца ожидается новая волосяная луковица в основании того же фолликула, что и новый преемник волосяного стержня анагена. По мере роста старые телогенные волосы удаляются. В таком процессе каждый выпавший волос в идеале заменяется новым. Хотя фактические механизмы, участвующие в выпадении волос, полностью не идентифицированы, процесс, ведущий к окончательному выпадению волос, возможно, управляется сочетанием активности протеаз и ингибиторов протеаз [9–11].По завершении фазы телогена стержень косолапого волоса остается неплотно прикрепленным к внешней корневой оболочке фолликула.
Он включает эпителиальный рост волосяной луковицы глубоко в дерму с образованием стержня волоса (рис. 1). По завершении этой фазы роста волосяная луковица следует за быстрой инволюцией волосяного фолликула во время фазы катагена. Волосяной фолликул втягивается до средней части волосяного фолликула и переходит в фазу покоя телогена.Около 15-20% волос на коже головы обычно находятся в телогене. В среднем через три месяца ожидается новая волосяная луковица в основании того же фолликула, что и новый преемник волосяного стержня анагена. По мере роста старые телогенные волосы удаляются. В таком процессе каждый выпавший волос в идеале заменяется новым. Хотя фактические механизмы, участвующие в выпадении волос, полностью не идентифицированы, процесс, ведущий к окончательному выпадению волос, возможно, управляется сочетанием активности протеаз и ингибиторов протеаз [9–11].По завершении фазы телогена стержень косолапого волоса остается неплотно прикрепленным к внешней корневой оболочке фолликула.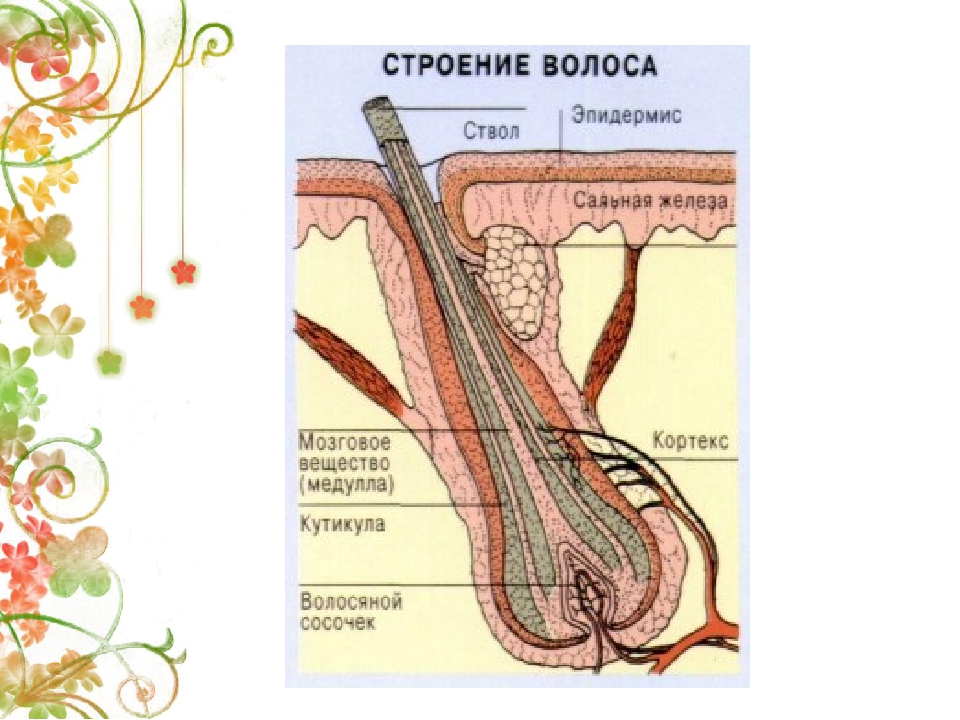 Конец фазы телогена во время выпадения волос соответствует фазе телоптоза / экзогена [12, 13]. Волосы выпадают самопроизвольно или удаляются осторожным расчесыванием и мытьем. Считается, что они вытесняются, когда появляются новые волосы в анагене. Однако процесс выпадения волос, возможно, происходит у человека независимо от других фаз цикла волос [1, 5].
Конец фазы телогена во время выпадения волос соответствует фазе телоптоза / экзогена [12, 13]. Волосы выпадают самопроизвольно или удаляются осторожным расчесыванием и мытьем. Считается, что они вытесняются, когда появляются новые волосы в анагене. Однако процесс выпадения волос, возможно, происходит у человека независимо от других фаз цикла волос [1, 5].
Система хронобиологического контроля, управляющая циклическими процессами в волосяном фолликуле, остается предполагаемой.Контроль начала и продолжительности любой фазы цикла волос сложен. Возможно, они включают серию синхронизаторов с повышающей и понижающей регулировкой. Весь процесс поддерживает рост волос, переходя от одной стадии роста в цикле роста волос к следующей [12].
Во время круговорота волос задействован ряд типов и структур клеток. Они включают эндотелиальные клетки, лимфоциты, базальные мембраны, протеогликаны и прилегающие конститутивные клетки эпидермиса, дермы и гиподермы [14]. Возможно, они влияют на цикл. Не установлено, являются ли некоторые из этих изменений причинными или сопутствующими признаками. Наиболее очевидная движущая сила в цикле роста волос исходит как от фолликулярного сосочка, так и от перифолликулярного матрикса. Действительно, во время цикла роста волос в этих структурах происходят заметные структурные изменения. Фолликулярный сосочек в установленном анагене имеет большие размеры. В телогене он становится меньше и компактнее. Размер фолликулярного сосочка определяет размер и форму фолликула [14–16], которые, в частности, определяются расположением тела.Различные размеры сосочков во время цикла роста волос отражаются во внеклеточном матриксе, ремоделируясь с накоплением протеогликанов, включая версикан [17]. Сосудистые структуры становятся более заметными в фазе роста. Факторы папиллярных мезенхимальных клеток, вероятно, действуют на фолликулярный эпителий. В начале фазы анагена факторы сосочка влияют на стволовые клетки волосяного фолликула, которые восприимчивы к индуктивным сигналам [18].
Не установлено, являются ли некоторые из этих изменений причинными или сопутствующими признаками. Наиболее очевидная движущая сила в цикле роста волос исходит как от фолликулярного сосочка, так и от перифолликулярного матрикса. Действительно, во время цикла роста волос в этих структурах происходят заметные структурные изменения. Фолликулярный сосочек в установленном анагене имеет большие размеры. В телогене он становится меньше и компактнее. Размер фолликулярного сосочка определяет размер и форму фолликула [14–16], которые, в частности, определяются расположением тела.Различные размеры сосочков во время цикла роста волос отражаются во внеклеточном матриксе, ремоделируясь с накоплением протеогликанов, включая версикан [17]. Сосудистые структуры становятся более заметными в фазе роста. Факторы папиллярных мезенхимальных клеток, вероятно, действуют на фолликулярный эпителий. В начале фазы анагена факторы сосочка влияют на стволовые клетки волосяного фолликула, которые восприимчивы к индуктивным сигналам [18].
3. Координация между последовательными циклами волос
У субъектов с пониженной густотой волос большинство фолликулов содержат только один волос, а некоторые другие кажутся пустыми [19].Напротив, в условиях пухлости фолликулы обычно содержат пару волосков. Этот аспект, возможно, связан с тем, что несколько волосяных фолликулов совместно используют один воронок. Дальнейшее влияние на этот паттерн оказывает замедленный телоптоз [13]. Телоптоз может возникать одновременно с тем, что волосяной фолликул инициирует следующую раннюю стадию анагена или уже некоторое время находится в анагене.
Напротив, в некоторых условиях волосы телогена теряются до того, как становятся видимыми волосы следующего анагена.В латентный период волосяной фолликул при клиническом осмотре кажется пустым [20–22]. Время задержки перед экструзией волос следующего поколения соответствует феномену затмения волос [22]. Эта физиологическая особенность более или менее продолжительна, в среднем достигая 4-7 месяцев [20, 23]. Очевидно, это влияет на густоту волос на коже головы. Феномен затмения волос, вероятно, зависит от ряда различных синхронизаторов. Это является результатом некоторых нарушений в циклическом движении волос, включая ранний телоптоз, задержку начала анагена или задержку роста волос на любом этапе во время стадии анагена.Таким образом, феномен затмения волос представляет собой беспорядочный процесс, происходящий в ряде физиопатологических состояний, влияющих на волосяные фолликулы по отдельности или в фокусе или в общих формах. Это чаще возникает после синхронного телоптоза, возникающего при телогеновой алопеции, такого как послеродовая алопеция. Локальные синхронизаторы, включая факторы роста и другие медиаторы, в конечном итоге отсутствуют или участвуют в феномене затмения волос. Их идентификация и характеристика могут привести к появлению новых корректирующих и профилактических применений.
Очевидно, это влияет на густоту волос на коже головы. Феномен затмения волос, вероятно, зависит от ряда различных синхронизаторов. Это является результатом некоторых нарушений в циклическом движении волос, включая ранний телоптоз, задержку начала анагена или задержку роста волос на любом этапе во время стадии анагена.Таким образом, феномен затмения волос представляет собой беспорядочный процесс, происходящий в ряде физиопатологических состояний, влияющих на волосяные фолликулы по отдельности или в фокусе или в общих формах. Это чаще возникает после синхронного телоптоза, возникающего при телогеновой алопеции, такого как послеродовая алопеция. Локальные синхронизаторы, включая факторы роста и другие медиаторы, в конечном итоге отсутствуют или участвуют в феномене затмения волос. Их идентификация и характеристика могут привести к появлению новых корректирующих и профилактических применений.
Основные причинные механизмы феномена генерализованного затмения волос, вероятно, разнообразны.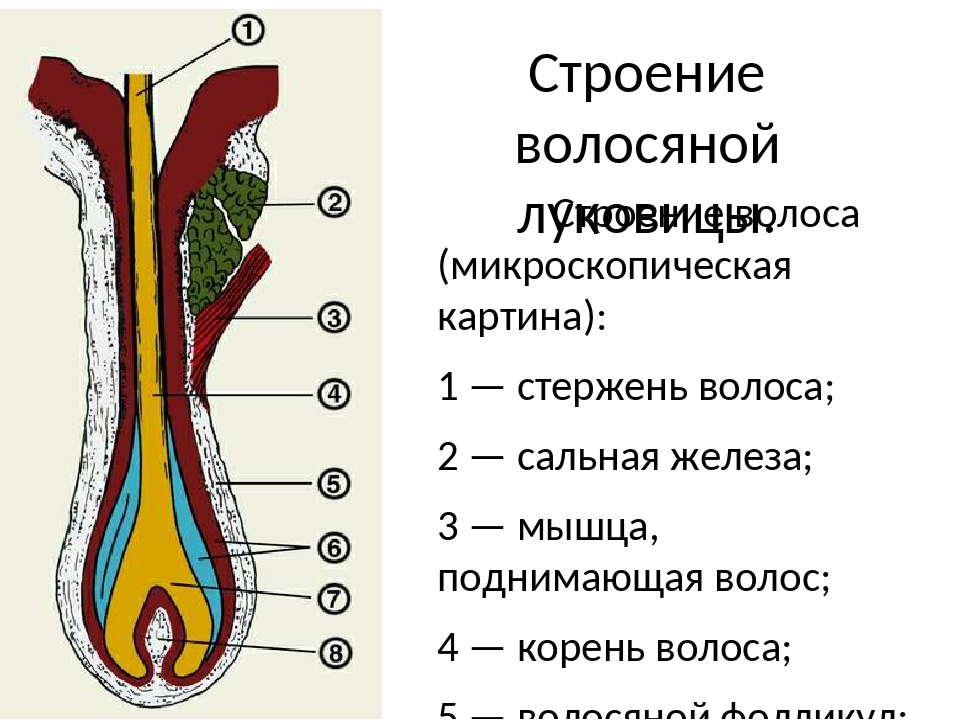 Они остаются неурегулированными. Два типичных примера представлены остановкой роста волос во время фазы миданагена при очаговой алопеции и временным облысением, возникающим у некоторых новорожденных или после химиотерапии. За хроническим оттоком телогена [21] также следует феномен затмения волос. Разнообразие причин и механизмов, участвующих в феномене волосяного затмения, примечательно [5, 20].
Они остаются неурегулированными. Два типичных примера представлены остановкой роста волос во время фазы миданагена при очаговой алопеции и временным облысением, возникающим у некоторых новорожденных или после химиотерапии. За хроническим оттоком телогена [21] также следует феномен затмения волос. Разнообразие причин и механизмов, участвующих в феномене волосяного затмения, примечательно [5, 20].
4. Послеродовое выпадение волос
Большинство женщин страдают от выпадения телогена в послеродовом периоде [1, 24, 25]. Действительно, во время беременности фаза телоптоза / экзогена задерживается, и количество выпадающих волос уменьшается, вызывая увеличение пухлости волос. После родов циклы волос на коже черепа у этих женщин синхронизируются, что приводит к синхронному процессу телоген-телоптоза [26]. В то время выпадение волос кажется обильным, но представляет собой только устранение дополнительных волос, которые поддерживались в фазе анагена и не были потеряны во время беременности. Во второй и третьей четверти беременности только около 10% волос находятся в телогене.
Во второй и третьей четверти беременности только около 10% волос находятся в телогене.
Послеродовое выпадение волос является обычным явлением и считается незначительным неудобством для женщин, которые ранее прошли через это. Тем не менее, это, возможно, представляет собой паническое состояние для тех, кто испытывает это впервые. Тот же процесс действует при тяжелых лихорадочных состояниях. В течение первых недель послеродового периода волосы поступают в телоген синхронной волной, достигая в среднем 30% через девять недель.Это объясняет клиническое наблюдение, согласно которому послеродовое выпадение волос происходит через два-четыре месяца после родов. Обычно это продолжается от 6 до 24 недель, но редко длится до 15 месяцев.
Послеродовое выпадение волос на коже черепа диффузное, но выражено по передней линии волос. Практически все волосы заменяются через несколько недель, если какой-либо другой процесс не разоблачает женское облысение.
5. Волосяные фолликулы во время климактерического периода
Средний возраст естественной менопаузы составляет около 49–51 лет.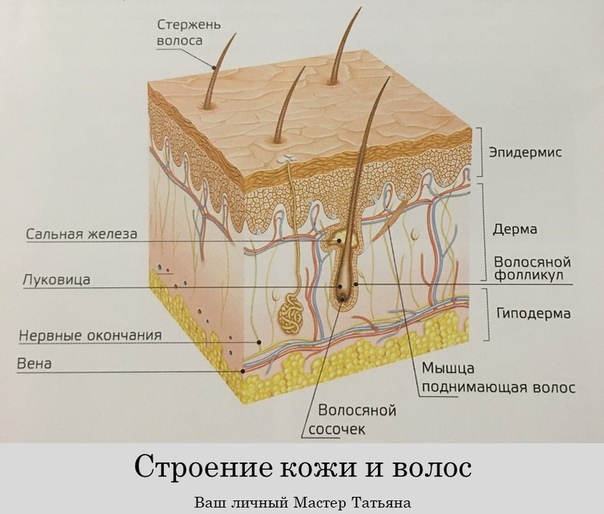 Часто в этот период жизни поражаются волосяные фолликулы. В самом деле, волосы представляют собой особую рецепторную структуру, выражающую снижение, связанное с колебаниями циркулирующих уровней половых стероидов. Двумя основными изменениями в распределении волос, наблюдаемыми в период менопаузы, являются алопеция по женскому типу (FPA) и лицевой гирсутизм. Оба состояния часто бывают сопутствующими и становятся более выраженными с возрастом в постменопаузальный период. Сообщалось, что тиболон как альтернатива заместительной гормональной терапии (ЗГТ) увеличивает тяжесть диффузной алопеции и, возможно, вызывает гипертрихоз лица [27].Фронтальная фиброзная алопеция (FFA) – это отдельное состояние, которое, вероятно, усугубляется менопаузой, хотя оно не контролируется с помощью ЗГТ.
Часто в этот период жизни поражаются волосяные фолликулы. В самом деле, волосы представляют собой особую рецепторную структуру, выражающую снижение, связанное с колебаниями циркулирующих уровней половых стероидов. Двумя основными изменениями в распределении волос, наблюдаемыми в период менопаузы, являются алопеция по женскому типу (FPA) и лицевой гирсутизм. Оба состояния часто бывают сопутствующими и становятся более выраженными с возрастом в постменопаузальный период. Сообщалось, что тиболон как альтернатива заместительной гормональной терапии (ЗГТ) увеличивает тяжесть диффузной алопеции и, возможно, вызывает гипертрихоз лица [27].Фронтальная фиброзная алопеция (FFA) – это отдельное состояние, которое, вероятно, усугубляется менопаузой, хотя оно не контролируется с помощью ЗГТ.
6. Климактерическое выпадение волос
Большинство женщин в развитых странах ожидают, что после менопаузы проведут треть или более своей жизни. Старение, связанное с климактерическими гормональными изменениями, обычно влияет на некоторые характеристики волос и является причиной уменьшения покрытия волос у женщин среднего возраста [28]. Наиболее распространенной формой прогрессирующей алопеции у пожилых женщин является FPA, которая часто ухудшается во время перименопаузы, особенно если это состояние присутствовало ранее [29, 30].Уменьшение продолжительности фазы анагена и регресс волос на коже головы до более тонких пушковых волос вызваны, в частности, андрогенами. Обычно они приводят к климактерической алопеции [23]. Следует отметить, что у некоторых женщин с алопецией не наблюдается повышения уровня циркулирующих андрогенов, что позволяет предположить, что у них много андрогенных рецепторов кожи или задействованы другие андроген-независимые механизмы [29]. FPA особенно влияет на волосяные фолликулы в теменной и лобно-сагиттальной областях, вызывая истончение битемпоральных волос, но оставляя нетронутой переднюю линию роста волос [29, 31].В этом состоянии как роговой слой кожи головы, так и стержни волос показывают пониженный уровень емкости, указывающий на нарушение увлажнения [32, 33].
Наиболее распространенной формой прогрессирующей алопеции у пожилых женщин является FPA, которая часто ухудшается во время перименопаузы, особенно если это состояние присутствовало ранее [29, 30].Уменьшение продолжительности фазы анагена и регресс волос на коже головы до более тонких пушковых волос вызваны, в частности, андрогенами. Обычно они приводят к климактерической алопеции [23]. Следует отметить, что у некоторых женщин с алопецией не наблюдается повышения уровня циркулирующих андрогенов, что позволяет предположить, что у них много андрогенных рецепторов кожи или задействованы другие андроген-независимые механизмы [29]. FPA особенно влияет на волосяные фолликулы в теменной и лобно-сагиттальной областях, вызывая истончение битемпоральных волос, но оставляя нетронутой переднюю линию роста волос [29, 31].В этом состоянии как роговой слой кожи головы, так и стержни волос показывают пониженный уровень емкости, указывающий на нарушение увлажнения [32, 33].
Постменопаузальная СЖК представляет собой отчетливую рубцовую алопецию [34–36]. Это соответствует прогрессирующему состоянию, ответственному за разрушение верхней части волосяного фолликула инфильтратом лимфоидных клеток. Этот процесс вызывает характерный узор разрежения волос, соответствующий симметричной регрессии лобной и височной линии роста волос в сочетании с частичной или полной потерей бровей [34–36].Начало выпадения волос особенно сложно идентифицировать, поскольку пациенты обращаются к врачу относительно поздно во время прогрессирования заболевания. Следовательно, FFA часто стабильна, и это влияет на эффективность лечения [25, 36]. Кроме того, остается нерешенным вопрос о том, как климактерические изменения вызывают это избирательное воздействие на лобно-височную часть кожи головы. Однако сообщалось о некоторой пользе у нескольких пациентов после андроген-зависимой терапии [24, 26, 35].
Это соответствует прогрессирующему состоянию, ответственному за разрушение верхней части волосяного фолликула инфильтратом лимфоидных клеток. Этот процесс вызывает характерный узор разрежения волос, соответствующий симметричной регрессии лобной и височной линии роста волос в сочетании с частичной или полной потерей бровей [34–36].Начало выпадения волос особенно сложно идентифицировать, поскольку пациенты обращаются к врачу относительно поздно во время прогрессирования заболевания. Следовательно, FFA часто стабильна, и это влияет на эффективность лечения [25, 36]. Кроме того, остается нерешенным вопрос о том, как климактерические изменения вызывают это избирательное воздействие на лобно-височную часть кожи головы. Однако сообщалось о некоторой пользе у нескольких пациентов после андроген-зависимой терапии [24, 26, 35].
7. Беременность и климактерический гирсутизм на лице
Повышенный рост волос во время беременности – редкое состояние, связанное с признаками вирилизации, такими как низкий голос, прыщи и увеличение клитора.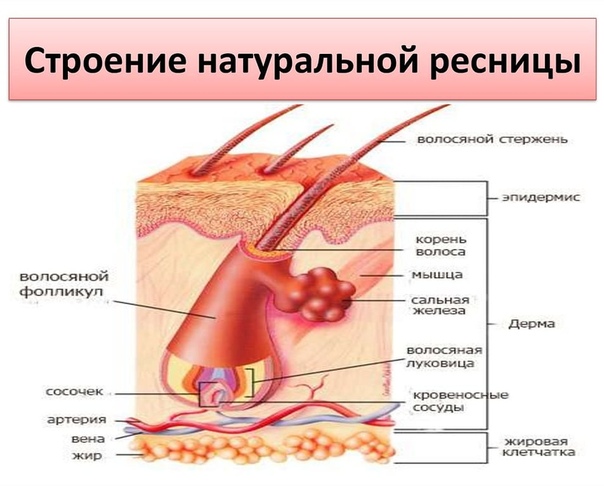 У некоторых из этих пациенток была обнаружена арренобластома, а у других женщин двустороннее увеличение яичников является результатом гиперплазии лютеиновых клеток. Вирилизация, возможно, исчезает в послеродовом периоде в связи со спонтанным уменьшением размера яичников.
У некоторых из этих пациенток была обнаружена арренобластома, а у других женщин двустороннее увеличение яичников является результатом гиперплазии лютеиновых клеток. Вирилизация, возможно, исчезает в послеродовом периоде в связи со спонтанным уменьшением размера яичников.
Волосы на теле у женщин обычно имеют тенденцию расти до наступления менопаузы. В дальнейшем он начинает уменьшаться. Напротив, волосы на лице имеют тенденцию увеличиваться даже у пожилых людей. Распространенность гирсутизма у женщин в постменопаузе полностью не задокументирована [37].Около 50% женщин сообщают о чрезмерном росте волос на лице после менопаузы [38]. Эта особенность свидетельствует о том, что во многих случаях недооценивается как клиническое, так и социальное значение этой проблемы.
В целом гирсутизм возникает из-за повышенной выработки андрогенов или повышенной чувствительности волосяных фолликулов к этим гормонам [39]. Андрогены отвечают за увеличение размера волосяного фолликула, диаметра стержня волоса, продолжительности фазы анагена терминальных волос и выработки кожного сала.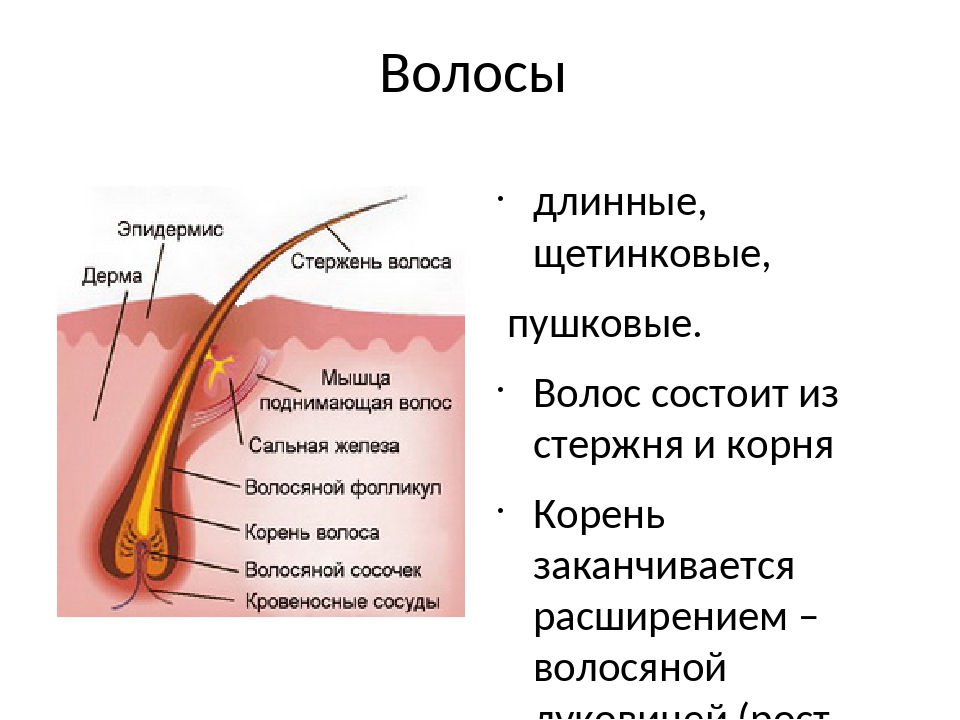 Все эти аспекты обычно присутствуют при гирсутизме [40].Подавляющее большинство женщин с волосатым волосом страдают доброкачественным причинным заболеванием. Двумя основными причинами являются синдром поликистозных яичников (СПКЯ) и идиопатический гирсутизм с уровнем циркулирующих андрогенов в пределах нормы [41–45]. Хотя СПКЯ и связанный с ним гормональный дисбаланс наблюдались после менопаузы, уровень гиперандрогении был скромным.
Все эти аспекты обычно присутствуют при гирсутизме [40].Подавляющее большинство женщин с волосатым волосом страдают доброкачественным причинным заболеванием. Двумя основными причинами являются синдром поликистозных яичников (СПКЯ) и идиопатический гирсутизм с уровнем циркулирующих андрогенов в пределах нормы [41–45]. Хотя СПКЯ и связанный с ним гормональный дисбаланс наблюдались после менопаузы, уровень гиперандрогении был скромным.
Более серьезные, но редкие причины гирсутизма включают врожденную гиперплазию надпочечников и синдром Кушинга, а также некоторые доброкачественные и злокачественные андроген-секретирующие опухоли яичников и надпочечников [38, 46, 47].Сообщалось о гиперандрогении, вызванной ганглионевромой надпочечников [48], и гиперандрогении, связанной с яичниками, связанной с гирсутизмом, включая гипертекоз яичников [49–51] и новообразования яичников [52]. Тяжелая вирилизация незлокачественного происхождения у женщин в постменопаузе встречается редко. Иногда гирсутизм в постменопаузе следует за андрогенной терапией, включая терапию тестостероном [53] и терапию андроген-эстрогеном [54].
8. Заключение
Подчеркивая уникальность некоторых заболеваний волос у женщин, эти заболевания и их лечение должны стать предметом более пристального внимания.Конечная цель – лучше предотвращать, диагностировать и лечить заболевания волос у женщин. Причины гирсутизма и выпадения волос, а также лечение этих состояний иногда отличаются у женщин в постменопаузе по сравнению с женщинами более молодого репродуктивного возраста [55]. Некоторые женщины в постменопаузе, вероятно, заслуживают особой заботы и внимания, вступая в новую фазу своей жизни, поддерживаемую сложными физиологическими изменениями. Хронобиология, регулирующая цикл волос, – увлекательный и сложный процесс.
Благодарности
Работа поддержана грантом «Fonds d’Investissement de la Recherche Scientifique» университетской больницы Льежа. Никакие другие источники финансирования не использовались для подготовки этого документа. У авторов нет конфликта интересов, имеющего прямое отношение к содержанию обзора. Авторы признательны г-же Иде Леклерк и Мари Пульезе за прекрасную секретарскую помощь.
Дермальная конденсация волосяного фолликула образуется через выход примированного Fgf20 клеточного цикла, подвижность клеток и агрегацию
Существенные изменения:
1) Введение и обсуждение.Рецептор нейротрофина p75 кДа необходимо включить в список ранних маркеров конденсата мезенхимальных клеток, и необходимо указать соответствующую рукопись (PMID: 10588868). Фактически, удаление p75NTR приводит к усилению регуляции FGFR2 в фолликулярном сосочке, обеспечивая тем самым функциональную связь между передачей сигналов p75NTR и FGF в мезенхимальных клетках.
Спасибо за предложение. Мы упомянули p75NTR в списке ранних маркеров дермального конденсата во Введении и процитировали статью (второй абзац).Интересно отметить, что делеция p75NTR приводит к усилению регуляции Fgfr2, и, безусловно, может быть, что устранение Fgf20 приводит к отсутствию p75NTR и усилению регуляции Fgfr2, однако мы не тестировали ни одну из этих молекул и, следовательно, не хотели бы спекулировать на этой связи. в этой рукописи.
2) Рис. 2. Чтобы лучше обосновать отсутствие потенциального вклада Sox2 + Шванновских клеток в образование мезенхимального конденсата, авторы могли бы пожелать процитировать данные, показывающие отсутствие Шванновских клеток, связанных с нервными волокнами в E14.5 дермы мыши (PMID: 12012374).
Благодарим рецензентов за это предложение. Однако благодаря открытию Fgf20 в качестве раннего маркера волосяного фолликула и использованию маркера нейрофиламентов 2h4 и маркера предшественника шванновских клеток Sox2 мы наблюдаем сторожевые волосяные фолликулы уже в коже мышей E13.5 с тесно связанными нервными волокнами, слегка украшенными -окрашенные клетки Sox2 + (см. стрелки на изображении ответа автора 1, масштабная линейка = 10 мкм). Это открытие согласуется с профилем RNAseq E14.5 на коже эмбриона (www.hair-GEL.net, PMID: 26256211), показывающая присутствие Sox2 + шванновских клеток во время индукции первичного волосяного фолликула.
3) Рисунки 4 и 6. Миграция эпителиальных клеток связана с усилением иммуноокрашивания фаллоидином сети эндогенных актиновых филаментов. Есть ли шанс продемонстрировать такую сеть в фибробластах, участвующих в образовании конденсата мезенхимальных клеток?
Это отличный момент.Мы использовали Sox2-GFP для идентификации как клеток DC, так и мигрирующих клеток DC, и сравнили актиновую сеть этих клеток за пределами DC с фибробластами, отличными от DC. Эти данные были добавлены в качестве рисунка 4 – рисунок в приложении 2A, B. Мы наблюдали увеличение интенсивности окрашивания F-актина в клетках Sox2 + за пределами DC по сравнению с фибробластами Sox2-non-DC, что, вероятно, указывает на их миграционный статус. Интересно, что мы наблюдали еще более высокую интенсивность окрашивания F-актина в клетках Sox2 + DC.Мы далее сравнили интенсивность окрашивания фаллоидином в DC и сравнили его с соседней мезенхимой, отличной от DC, и обнаружили, что оно было значительно увеличено в DC на всех этапах, изученных в этом исследовании (новый рисунок 4 – приложение к рисунку 2C, D ). В нашем анализе живой ткани эти клетки показали пониженную подвижность (рис. 4D, F), и вполне вероятно, что F-актин в этих клетках участвует в поддержании трехмерной структуры DC.
4) Количество мышей, использованных для каждого эксперимента, четко не указано (за исключением анализа RNAseq).Множественные плакоды должны быть исследованы на множестве мышей, чтобы учесть различия между животными. Учитывая небольшое количество изученных плакод, кажется вероятным, что во многих экспериментах использовалось только одно животное. Незначительный момент. Для большинства экспериментов было неясно, из какого числа взяты наборы данных об эмбрионах. В частности, на рисунке 4 количество отслеживаемых клеток кажется низким, и неясно, отслеживались ли несколько фолликулов. Укажите n значений для # ячеек в # плакодах и # эмбрионах.
Мы согласны с тем, что это может вызывать беспокойство, и приносим свои извинения за то, что не сообщили о размерах выборки в достаточных подробностях. В каждом эксперименте мы использовали несколько эмбрионов. Мы предоставили количество эмбрионов, количество плакод и количество клеток, использованных в легенде каждого рисунка.
5) Поскольку исходный цветовой контраст Fucci не так хорош, как более поздние версии мышей, следует использовать дополнительный метод для подтверждения выхода из клеточного цикла (например, окрашивание фосфогистоном h4 или короткая погоня после введения аналога тимидина).
Мы исследовали модель Fucci2a (Mort et al., 2014), второе поколение мышей-индикаторов клеточного цикла, во время морфогенеза DC и находим результаты, согласующиеся с результатами, полученными с исходным штаммом Fucci (подраздел «Образование дермального конденсата связано с выход из клеточного цикла », первый абзац, и репрезентативные цифры показаны на новом рисунке 3 – рисунок в приложении 1). Кроме того, мы провели 2-часовые импульсы EdU и количественно определили процент клеток EdU + в популяции клеток Sox2 + DC.На стадии I плакоды в среднем 18% клеток Sox2 + были EdU + , тогда как на стадиях II-IV плакод наблюдали очень мало клеток EdU + , что соответствует данным Fucci. Данные EdU были добавлены на рисунок 3 в виде панелей F и G и в результаты (в последнем абзаце вышеупомянутого подраздела).
6) Поскольку SU5402 является широким ингибитором (VEGFR2, FGFR1, PDGFRB), необходимы другие средства контроля, чтобы продемонстрировать, что результаты исследований кожных эксплантатов не являются результатом передачи сигналов Pdgf или Vegf или других молекул FGF, особенно потому, что% клеток Sox2 + снижалось в ответ на обработку SU5402.
Мы благодарим рецензентов за то, что они подняли этот вопрос. Значения половины максимальной ингибирующей концентрации (IC 50 ) для областей SU5402 указаны в таблице ниже. Основываясь на нашем опыте, более высокие концентрации необходимы для ингибирования рецепторов в экспериментах на культуре органов. Мы использовали SU5402 в концентрации 20 мкМ для достижения описанного эффекта; при 10 мкМ мы не наблюдали никакого эффекта на образование плакод / DC (n = девять кож) (данные не показаны). Значения IC 50 показывают, что ингибирование PDGFRβ достигается при концентрации SU5402 в 17 раз большей, чем при ингибировании FGFR.Кроме того, условная делеция как PDGFRβ, так и PDGFRα в развивающейся дерме и особенно в дермальном конденсате во время морфогенеза волосяного фолликула не приводит к фенотипу (Rezza et al., 2015). Таким образом, мы считаем маловероятным, что результаты будут вызваны ингибированием передачи сигналов Pdgf.
Мы согласны с тем, что потенциальное ингибирование передачи сигналов Vegf вызывает беспокойство. Поэтому мы использовали ингибитор, который более специфичен для FGFR (BGJ398; см. Таблицу ниже для значений IC 50 ) и обнаружили, что аналогично SU5402, в E13.5 эксплантатов обрабатывали в течение 24 часов, ДК не развивались, а рисунок плакод напоминал модель Fgf20-KO. Кроме того, мы использовали специфический ингибитор VEGFR (кабозантиниб, XL184). При концентрации, эквивалентной 20 мкМ SU5402 (на основании значений IC 50 ), т.е. 50 нМ, мы не обнаружили влияния на образование DC или эпителиальный паттерн. Даже 5-кратное повышение концентрации (250 нМ) не влияло на формирование плакод / DC. IC 50 значения ингибиторов и репрезентативные цифры этих данных теперь доступны на Рисунке 7 – рисунки 2 и 3, соответственно.Основываясь на этих данных, мы заключаем, что эффект SU5402 обусловлен ингибированием передачи сигналов Fgfr, и обеспечиваем подтверждение роли передачи сигналов FGF в морфогенезе DC.
| Реактив | FGFR1 IC 50 | VEGFR2 IC 50 | PDGFRβ IC 50 |
| SU5402 | 9014 9014 9014 9014 9014 9014 9014 9014 9014 9014 9014 9014 9014 9014 9014 9014 9014 9014 9014 9014 9014 9014 9014 9014 9014 9014 0,9 нМ | 180 нМ | Не входит в комплект |
| Кабозантиниб | 5.294 мкМ | 0,035 нМ | Не предусмотрено |
7) Нерешенный вопрос – сроки и порядок событий при формировании ДЦ. Из данных, представленных на рисунках 2 и 3, кажется, что фибробласты сначала перемещаются в область DC посредством миграции / агрегации, затем включают экспрессию Sox2 и выходят из клеточного цикла. Или они выходят из клеточного цикла, начинают мигрировать, а затем включают экспрессию Sox2? Хотя авторы подчеркивают преимущество использования визуализации в реальном времени для документирования образования постоянного тока, оно используется только в одном эксперименте (рис. 4), но это позволило бы установить порядок событий в процессе.
Согласны, что это очень интересный вопрос. В наших первоначальных экспериментальных экспериментах с интервальной съемкой использовались трансгены Fucci G 1 , Fucci S / G 2 / M и Sox2-GFP, однако мы не чувствовали, что можем надежно отличить Sox2-GFP от Azami Green. в Fucci S / G 2 / M, в частности в клетках, экспрессирующих низкие уровни Sox2-GFP. Из-за этих технических проблем и с учетом того, что эти ткани являются трансгенными репортерами, мы неохотно делаем какие-либо убедительные выводы относительно порядка событий на основе наших покадровых данных.
Чтобы решить этот вопрос, мы сравнили процент клеток Fucci-G 1 DC (т. Е. Sox2-положительных клеток) на прогрессирующих стадиях плакод (рис. 3B) и обнаружили, что значительно меньше клеток Sox2 + DC являются Fucci- G1 положительный на стадии I плакоды по сравнению с более поздними стадиями плакоды (p I vs II = 0,0211; p II vs III = 0,8303, p III vs IV = 0,1579). Кроме того, наш новый анализ EdU в Sox2, экспрессирующих клетки DC, показывает аналогичные результаты (новые рисунки 3F и G).Основываясь на этих данных, мы заключаем, что приобретение судьбы DC (оцениваемое по положительности Sox2) предшествует выходу из клеточного цикла. Мы добавили одно предложение по этому поводу в разделе «Результаты»: «Кроме того, процент непролиферирующих клеток на стадии I DC был значительно ниже, чем на следующих стадиях (p IvsII = 0,0211), предполагая, что приобретение судьбы DC происходит до выхода из клеточного цикла. . » Мы надеемся ответить на этот важный вопрос в будущих исследованиях с помощью более сложных инструментов.
8) На фиг. 6 показано, что добавления FGF к культивируемым фибробластам достаточно для увеличения скорости миграции, но верно ли это in vivo, неизвестно.Эксперименты с шариками несколько неубедительны – хотя шариков, покрытых FGF, достаточно для индукции экспрессии некоторых генов-мишеней, эффект слишком кратковременный, чтобы отслеживать миграцию.
Похоже, что Fgf20 достаточно, чтобы вызвать изменения плотности клеток и формы клеток в клетках, расположенных рядом с шариком. Меня беспокоят разные размеры шариков в контрольных и экспериментальных образцах, показанных на рис. 6D и 6F – кажется, окружность шарика / площадь поверхности могут повлиять на локальную плотность и форму ячеек.Кроме того, я считаю, что метки на рис. 6E перевернуты. Согласно графику, BSA имеет больше клеток / мкм2, чем Fgf20, но можно сделать вывод, что Fgf20 увеличивает плотность клеток.
Мы приносим свои извинения за то, что не уточнили, что размер шариков, используемых в эксперименте, варьируется от 70 до 100 мкм в диаметре; мы добавили эту информацию в раздел «Материалы и методы». Бусы выбирались случайным образом для каждого эксперимента. Мы ретроспективно измерили диаметр всех шариков, используемых в этом эксперименте, и мы не обнаружили статистической разницы между гранулами, нагруженными FGF20 или FGF9, и их контролями.Диаметр гранул составлял (AVR ± S.D.): FGF20 = 87 ± 10 мкм, BSA (контроль для FGF20) = 85 ± 10 мкм, FGF9 = 87 ± 7 мкм и BSA (контроль для FGF9) = 86 ± 11 мкм. Согласно парному двустороннему T-критерию Стьюдента, гранулы, нагруженные FGF20 и FGF9, существенно не отличались от их контроля BSA (P FGF20-BSA = 0,736 и P FGF9-BSA = 0,923; n FGF20- BSA = 9 пар, n FGF9-BSA = 7 пар). Мы изменили изображение на рис. 6D и F, чтобы лучше соответствовать среднему размеру бусинок и избежать каких-либо недоразумений.
Приносим извинения за переворот этикеток на Рисунке 6E. Мы исправили ошибку.
9) Fgf20 на выходе из клеточного цикла. Данные хорошо показывают, что Fgf20 необходим для экспрессии p21 in vivo , но достаточно ли этого? Если гранулы, покрытые Fgf20, встроены в дерму Fucci, достаточно ли этого, чтобы вызвать выход из клеточного цикла?
Чтобы решить эту проблему, мы выполнили дополнительные 3-часовые эксперименты с бусинами на интактной мезенхиме. Используя антитело p21, мы не обнаружили никаких положительных клеток рядом с шариком.В дополнение к полной гибридизации in situ мы также использовали зонд, меченный 35 S, в срезах и не обнаружили индукции p21 вокруг шариков, покрытых FGF20 или FGF9. Также не удалось обнаружить значительного эффекта в процентном отношении клеток Fucci-G1 + вокруг FGF20 или FGF9 гранул. Таким образом, оказывается, что одного Fgf20 недостаточно для индукции p21 и выхода из клеточного цикла, и могут потребоваться дополнительные сигналы. В качестве альтернативы кинетика индукции p21 может быть медленнее, чем у ингибиторов обратной связи пути, таких как Spry4 и Dusp6.
https://doi.org/10.7554/eLife.36468.044Генерация первичного рисунка волосяных фолликулов
Абстрактные
Волосяные фолликулы расположены через кожу на равном расстоянии друг от друга. Хотя фолликулы являются преимущественно эпидермальными структурами, классические эксперименты по рекомбинации тканей показали, что нижележащая дерма определяет их местоположение во время развития. Хотя многие молекулы, участвующие в формировании волосяных фолликулов, были идентифицированы, молекулярные взаимодействия, которые определяют эмерджентное свойство формирования рисунка, остаются неуловимыми.Мы использовали культуры эмбриональной кожи, чтобы проанализировать сигнальные реакции и результаты формирования паттерна по мере того, как кожа организует себя в пространстве. Мы обнаружили, что взаимодействие между рецептором эктодисплазина (Edar) и морфогенетическим белком (BMP) и транскрипционными взаимодействиями играет центральную роль в генерации первичного паттерна волосяных фолликулов, при этом ключевым фактором в этом процессе является ограничение реакции, а не локализация индуцирующего лиганда. . Суть этого механизма формирования паттерна – это быстрая Edar-положительная обратная связь в эпидермисе, связанная с индукцией дермального BMP4 / 7 .BMP, в свою очередь, репрессируют эпидермальный Edar и, следовательно, судьбу фолликула. Активация Edar также индуцирует фактор роста соединительной ткани, ингибитор передачи сигналов BMP, позволяющий действовать BMP только на расстоянии от места их синтеза. В соответствии с этой моделью, трансгенная гиперактивация передачи сигналов Edar ведет к повсеместному перепроизводству волосяных фолликулов. Этот механизм активации-ингибирования Edar-BMP, по-видимому, работает вместе с лабильным препаттерном, подтверждая, что Edar-обеспечиваемая стабилизация активных фокусов β-catenin является ключевым событием в определении местоположения дефинитивных фолликулов.
Периодические узоры – повторяющаяся тема в анатомической организации. Примеры у различных организмов включают щетину насекомых, волосы млекопитающих, расположение листьев на растении и расположение устьиц на этих листьях. Во всех этих случаях положение каждого элемента в шаблоне определяется относительно других, а не абсолютного анатомического расположения. Поскольку регулярные паттерны так широко встречаются в природе, ключевой вопрос биологии развития состоит в том, как можно создать упорядоченный массив структур из изначально однородного поля клеток.В общих чертах такие паттерны могут быть сгенерированы с помощью двух сигналов с разным диапазоном действия (1, 2). Эти системы активации-ингибирования полагаются на активатор, который способствует ( i ) его собственному синтезу, ( ii ) предположению о данной клеточной судьбе и ( iii ) синтезу ингибитора этой судьбы. Решающим в создании пространственного паттерна является то, что активатор действует локально, тогда как ингибитор действует на расстоянии от места его образования. Предполагается, что эти типы молекулярных взаимодействий способны генерировать периодический паттерн за счет усиления стохастической асимметрии в начальных концентрациях активатора и ингибитора (1).
Клетки на поверхности эмбрионов млекопитающих способны стать либо волосяным фолликулом, либо поверхностным эпидермисом. Они координируют свой выбор судьбы, чтобы получить точечный рисунок фолликулов, полагаясь на общение внутри кожи, а не на какую-либо внешнюю информацию о местоположении. Рекомбинация эпидермальных и дермальных компонентов эмбриональной кожи установила, что связь между этими клеточными слоями абсолютно необходима для инициации развития волос и перьев и что дерма ответственна за индукцию морфологических изменений эпидермиса (3, 4).
Многие молекулы, которые играют роль в развитии волосяных фолликулов, были идентифицированы (5-8), но регуляторные отношения между сигнальными путями, участвующими в этом процессе, в значительной степени неизвестны. Это особенно важная проблема, потому что именно взаимодействия между молекулами, а не внутренняя функция какого-либо отдельного генного продукта, ответственны за организацию формирования паттерна. Один такой сигнальный путь, состоящий из внеклеточного лиганда эктодисплазина (Eda), его рецептора Edar и его цитоплазматического сигнального адаптера, связанного с Edar доменом смерти (Edaradd), необходим для развития определенного подмножества волосяных фолликулов.Мутация любого из этих трех генов, каждый из которых специфически экспрессируется в эпидермисе, вызывает идентичные фенотипы эктодермальной дисплазии у мышей и людей (9-12). Этот фенотип включает полное отсутствие первичных волосяных фолликулов, которые у мышей образуются между 13-м и 16-м днем эмбриона. Похоже, что мутантный эпидермис Edar сохраняет свое первоначальное состояние до E17, когда начинают развиваться вторичные фолликулы (10, 13). Формирование вторичных фолликулов имеет отчетливую генетическую основу с мутациями в Noggin (14) или Lef1 (15), что позволяет инициировать первичный волосяной фолликул, но блокирует вторичные фолликулы.
Здесь мы изучаем роль пути Edar в формировании паттерна фолликулов с использованием культур эмбриональной кожи. Система культивирования позволяет проводить краткосрочные эксперименты с определенной начальной точкой. Эта особенность особенно важна для изучения сигнальных реакций, потому что она может отличить проксимальные эффекты экспериментальной манипуляции от тех, которые являются вторичными последствиями, вызванными изменением судьбы клеток. Мы обнаружили, что пространственная организация в эпидермисе достигается за счет модуляции восприимчивости к сигналам, при этом взаимодействия активации-ингибирования Edar-bone morphogenetic protein (BMP) управляют процессом формирования паттерна.
Результаты
Ограничение реакции Eda регулирует плотность волосяных фолликулов.
Хотя системы активации-ингибирования обычно полагаются на дифференциальную доступность лиганда, лиганд в этой системе, Eda, является плохим кандидатом для передачи позиционной информации. Eda широко экспрессируется в эпидермисе (13) и при применении в диффузной форме позволяет формировать паттерн в культуре (16), а in vivo (17).Следовательно, мы рассматривали динамическую экспрессию Edar как средство для генерации паттерна судьбы точечных клеток. Перед инициированием волосяного фолликула Edar равномерно экспрессируется через кожу, но по мере появления паттерна он становится активированным в зачатках фолликула и подавляется в окружающих клетках. Само это динамическое выражение зависит от передачи сигнала Эдара, потому что оно не наблюдается в Edaradd – / – эмбрионов (рис.1 А ).Таким образом, по мере формирования паттерна клетки отображают одно из трех состояний экспрессии; те, у кого не определяется Edar , вероятно, исключены из судьбы волосяного фолликула, те, у кого высокий уровень экспрессии, преданы этой судьбе, а те, у кого умеренная экспрессия, остаются компетентными для принятия любой судьбы. Количественная ОТ-ПЦР (кПЦР) выявила, что кожа Edaradd – / – эмбрионов экспрессируют такое же количество Edar , что и у их гетерозиготных однопометников (рис.1 В ). Этот результат показывает, что, хотя формирование паттерна резко реорганизует экспрессию Edar , оно уравновешивает фокальную повышающую регуляцию с широко распространенной понижающей регуляцией, так что общий уровень транскрипта сохраняется. Эти находки повышают вероятность того, что формирование паттерна фолликулов контролируется ограничением способности отвечать на Eda, при этом возникающие фолликулы блокируют экспрессию Edar и, следовательно, судьбу фолликулов в своем окружении.
Рисунок 1.Модуляция реакции Eda в развивающейся коже. ( A ) Выражение Edar в E12 WT, E14 WT и E14 Edaradd – / – мутантная кожа и полуколичественный анализ интенсивности сигнала Edar вдоль красной линии. (Масштаб: 100 мкм.) ( B ) Edar Уровни экспрессии в коже из Edaradd – / – и Эдарад +/- эмбрионов, нормализовано до Keratin14 . ( C ) Выражение Shh в WT и Eda – / – культур кожи, обработанных рекомбинантным белком Eda. Eda – / – Кожа демонстрирует краевой эффект с фокусами, выражающими Shh , выровненными по краю эксплантата ( нижний центр ).Высокие концентрации Eda вызывают образование полос на мутантной коже (наконечник стрелки). Каждая панель показывает 1 мм 2 . ( D ) Плотность волосяных фолликулов, индуцированная рекомбинантным Eda в E14 WT и Eda – / – скин. Планки погрешностей показывают SEM. ( E и F ) Время формирования паттерна и морфогенетических событий. ( E ) Edar выражение в E14 Eda – / – кожных культур после введения 50 нг / мл Eda.Каждая панель показывает 1 мм 2 . ( F ) Секционные Eda – / – кожа после введения Эды. Первым морфологическим признаком образования волосяного фолликула является конденсация клеток с образованием плакод (стрелки). (Масштаб: 25 мкм.)
Если ограничение Edar фолликулами и его подавление в окружающих их клетках являются ключевыми событиями в формировании паттерна, тогда кожа WT, которая уже содержит зачатки фолликулов, должна быть менее компетентной, чем мутантная кожа Eda для образования фолликулов в ответ на экзогенные Еда.Мы культивировали WT и Eda – / – Дорсальная кожа E14 в различных концентрациях рекомбинантного Eda и оценка плотности волосяных фолликулов путем обнаружения Shh (sonic hedgehog), раннего маркера волосяных фолликулов (18). Кожа WT содержит ≈30 фолликулов на квадратный миллиметр в отсутствие экзогенного Eda, увеличиваясь до 50 фолликулов на квадратный миллиметр при высоких концентрациях Eda. Eda – / – Кожа намного более восприимчива к Eda, генерируя максимум 90 фолликулов на квадратный миллиметр (рис.1 C и D ). При высоких концентрациях Eda мутантная кожа генерировала полосообразные узоры, которые никогда не наблюдались у WT (рис. 1). С ). Образование полос предсказывается в системах активации-ингибирования, когда концентрации активатора становятся насыщающими (19).
Мы заметили, что обработанные мутантные, но не WT, эксплантаты имели зачатки фолликулов, выровненные по их краям (рис. С ). Это наблюдение можно было бы объяснить, если бы клетки по краю ткани имели преимущество в формировании фолликула за счет освобождения от ингибирующих факторов клеток с одной стороны.Это краевой эффект и то, что Eda – / – Кожа может генерировать почти в два раза больше фолликулов, чем WT, утверждает, что конечное расположение фолликулов не предопределено у мутантов Eda . Эти результаты предполагают, что применение экзогенного Eda в этой культуральной системе инициирует формирование паттерна, а не просто обнаруживает ранее существовавший, загадочный паттерн. Взятые вместе, эти результаты связывают широко распространенную экспрессию Edar с широко распространенной способностью формировать волосяной фолликул и указывают на то, что существующие фолликулы вызывают ограничение этого потенциала развития.
Время формирования паттернов и морфогенетических событий.
Для изучения скорости формирования паттерна и морфогенеза фолликулов мы культивировали Eda – / – скин с Eda и фиксированные образцы в разные моменты времени. Мы обнаружили упорядоченный образец очагов, выражающих Edar , появляющихся через ≈10 часов после введения Eda, после чего пятна рассасывались и усиливались до 24 часов (рис. E ).Первый окончательный морфологический признак образования фолликулов, образование конденсированной плакоды, стал видимым только через 20 часов после нанесения Eda (рис. F ). Таким образом, в этой системе молекулярный препаттерн предшествует появлению морфологически идентифицируемых плакод на ≈10 ч.
Eda незаменим для формирования узоров.
Трансгенная линия OVE951 несет большое количество копий искусственной хромосомы дрожжей, которая включает весь локус Edar (20) и, следовательно, сверхэкспрессирует Edar в своем эндогенном паттерне (10).Мы количественно оценили экспрессию Edar в трансгенной коже на ст. E14, обнаружив, что она в 4 раза выше, чем в нетрансгенной коже (рис. А ). Мы обнаружили, что введение этого локуса, сверхэкспрессирующего Edar , в локус Eda – / – линия приводит к восстановлению образования первичных фолликулов, что определяется экспрессией Shh (рис. B – D ). Это открытие показывает, что умеренная сверхэкспрессия Edar приводит к передаче сигналов, не зависящей от лиганда, и иллюстрирует, что точный паттерн фолликулов может быть сформирован в отсутствие Eda.
Рис. 2.Eda незаменима для формирования узоров. ( A ) Определение qPCR экспрессии Edar в E14 Edaradd – / – нетрансгенный (NT) и Edaradd – / – скин OVE951. ( B- – D ) In situ обнаружение Shh в WT ( B ), Eda – / Y ( C ) и Eda – / Y ( D ) Эмбрионы OVE951 E15.Экспрессия обнаруживается только в вибриссах мутанта, но сверхэкспрессия Edar спасает мутантный фенотип, создавая точный паттерн фолликулов.
Сигнализация BMP запрещает выражение
Edar .Обнаружение того, что экспрессия Edar не обнаруживается в клетках, близких к формирующимся фолликулам, тогда как более отдаленные клетки экспрессируют умеренные уровни Edar , предполагает, что ранние волосяные фолликулы продуцируют диффузный ингибитор экспрессии Edar , который ограничивает способность предполагать эту судьбу в окружающих клетках.Два секретируемых лиганда были описаны как ингибиторы образования фолликулов: BMP (21, 22) и EGF (23). Обе эти молекулы блокируют опосредованное Eda образование фолликулов в культуре (рис. 3). A ), и поэтому оба являются кандидатами на роль Edar – подавляющее действие. Мы протестировали эти молекулы на ингибирование экспрессии Edar в культурах кожи эмбрионов. Важно, что ингибитор Edar должен действовать до принятия решения о судьбе фолликула, и поэтому он должен репрессировать базальную экспрессию Edar , наблюдаемую до формирования паттерна.Повышенная регуляция экспрессии Edar, наблюдаемая в зачатках фолликулов, может находиться под определенным регуляторным контролем. Поскольку мутантная кожа демонстрирует только широко распространенную умеренную экспрессию Edar (рис. A ), мы использовали его для этих экспериментов. Мы обнаружили, что BMP сильно подавляли экспрессию Edar , тогда как EGF этого не делал (рис. В ). Репрессия BMP Edar происходит быстро и коррелирует с уровнями фосфо-Smad1 / 5/8, активированной формы внутриклеточных преобразователей сигналов BMP (рис.3 С ).
Рис. 3.BMP подавляют экспрессию Edar . ( A ) BMP4 и EGF ингибируют образование фолликулов, индуцированное в Eda – / – скин от Eda. ( B ) Количественное определение экспрессии Edar в E13 Edaradd – / – Кожа, обработанная в течение 24 часов BMP или EGF.( C ) Динамическое ингибирование Edar BMP4 и соответствующие уровни фосфо-Smad. ( D ) Shh выражение в Eda – / – кожа, обработанная только Noggin, только Eda или Eda plus Noggin в течение 24 часов. ( E ) Плотность волосяных фолликулов в Eda – / – Кожа, обработанная Eda с Noggin или без него в течение 24 часов. Планки погрешностей показывают SEM.
Чтобы определить, влияют ли эндогенные BMP на формирование паттерна, мы использовали Noggin, специфический ингибитор BMP 2, 4 и 7 (24).Максимальная плотность волосяных фолликулов, достигаемая с помощью обработки Eda Eda – / – скин составлял ≈90 на квадратный миллиметр (рис. D ). Совместное лечение препаратом Noggin нарушило этот предел, позволив сформировать 140 фолликулов на квадратный миллиметр (рис. 3). D и E ), без образования полос. Этот результат демонстрирует, что эндогенные BMP ограничивают реакцию Eda во время формирования паттерна. Обработка одним только Noggin вызвала образование небольших скоплений фолликулов в мутантной коже, что указывает на то, что ослабления передачи сигналов BMP достаточно, чтобы позволить спорадическое образование фолликулов в отсутствие активности Edar (рис.3 D ).
BMP действуют на расстоянии от фолликула.
Поскольку сам фолликул продуцирует BMP (25) и имеет высокую экспрессию Edar , он должен использовать механизм, позволяющий уклоняться от понижающей регуляции Edar , управляемой BMP. Мы обнаружили, что фактор роста соединительной ткани (CTGF), который связывается с BMP и ингибирует их аналогично Noggin (26), экспрессируется в плакодах волосяных фолликулов (рис. 4). A ) и является быстро активируемой мишенью передачи сигналов Edar (рис.4 В ). В отличие от CTGF , другие ингибиторы передачи сигналов BMP, экспрессируемые в развивающейся коже [ Noggin , Smad7 и Sostdc1 (склеростиновый домен 1) / Ectodin / WISE (25, 27)] сами являются транскрипционными мишенями BMP (рис. 4). C ), вероятно, действуя как ингибиторы обратной связи сигнального пути. В соответствии с идеей о том, что плакода является зоной с приоритетом BMP, мишень BMP Sostdc1 экспрессируется вокруг и вдали от фолликулярных источников BMP, но не внутри них (рис.4 D ), а фосфо-Smad1 / 5/8 обнаруживается в межфолликулярном эпидермисе E15, но в основном отсутствует в формирующихся фолликулах (рис. E ). Совместная обработка культур кожи с Eda и BMP подавляет индукцию BMP его целевого гена Smad7 , с этим ослаблением транскрипционных ответов BMP, сопровождаемым подавлением фосфорилирования Smad (рис. F ). Способность Eda подавлять ответы BMP зависит от активации NF-κB, потому что фармакологическое подавление этого фактора транскрипции обеспечивает полный ответ BMP в присутствии Eda (рис.4 G и H ). Это открытие согласуется с ролью генов-мишеней Eda в ингибировании BMP, а не с каким-либо прямым вмешательством между компонентами путей передачи сигналов Eda и BMP. Таким образом, BMP действуют на расстоянии от места их синтеза, а сам ранний фолликул устойчив к их действию. Взятые вместе, эти эксперименты показывают, что BMPs проявляют характеристики тормозного плеча петли активации-ингибирования.
Инжир.4.BMP действуют на расстоянии от формирующегося фолликула. ( A ) CTGF экспрессируется в зачатках волосяных фолликулов в E15 WT, но не Eda – / – , эмбрионы. Выражение также заметно на веках. (Масштаб: 1 мм.) ( B ) Количественное определение мРНК CTGF в отделенном эпидермисе и дерме мутантной кожи, обработанной 1000 нг / мл Eda в течение 4 часов. Стимуляция Edar индуцирует экспрессию CTGF в эпидермисе, при этом наблюдается небольшая дермальная экспрессия.( C ) Количественное определение экспрессии гена в эпидермисе через 5 часов после добавления BMP4 ко всей коже. Noggin , Smad7 и Sostdc1 индуцируются обработкой BMP, тогда как CTGF – нет. ( D ) Sostdc1 экспрессируется вокруг зачатков фолликулов и вдали от них через 24 часа после введения Eda. (Масштаб: 100 мкм.) ( E ) Иммунодетекция фосфо-Smad1 / 5/8 в эпидермисе кожи E15 WT с низкими уровнями в плакодах фолликула (стрелка).(Масштаб: 100 мкм.) ( F ) Экспрессия Smad7 в эпидермисе через 5 часов после нанесения BMP4 с нанесением Eda или без него и соответствующими уровнями фосфорилирования Smad1 / 5/8 в эпидермисе. Совместное лечение с Eda подавляет вызванную BMP активацию Smad7, и фосфорилирование Smad1 / 5/8. ( G ) Экспрессия Smad7 в изолированном эпидермисе через 5 часов после BMP4 с применением или без применения Eda в присутствии ингибитора NF-κB BAY 11-7082. ( H ) Bay 11-7082 блокирует опосредованное Eda фосфорилирование IκBα в эпидермисе.Планки погрешностей показывают SEM.
Транскрипционные ответы на передачу сигналов Эдара.
Если Edar функционирует в плече активации этой петли, то он должен быть способен повышать свою собственную экспрессию, а также экспрессию BMP s. Для идентификации сигнальных мишеней Edar мы обработали Eda – / – культур с Eda и проанализировали экспрессию генов в изолированном эпидермисе и дерме.Мы использовали высокую дозу Eda для достижения грубой регуляции экспрессии целевого гена, а не для перемещения экспрессии, наблюдаемого во время процесса формирования физиологического паттерна. Edar Экспрессия умеренно активировалась Eda в течение 4 часов с подавлением передачи сигналов BMP при одновременном лечении с Noggin, усиливающим эту ауторегуляцию (рис. 5). А ). Анализ экспрессии BMP через 4 и 10 часов не обнаружил значительных изменений в уровнях BMP2 (данные не показаны), тогда как BMP4 сильно активировался в дерме через 10 часов (рис.5 В ). BMP7 показал наиболее быструю реакцию на Eda с первоначально низкими уровнями в дерме, которые активируются в течение 4 часов (рис. A ) и сильно повышается через 10 ч (рис. 5). В ). Eda-индуцированные BMP s были локально экспрессированы (фиг. 5). В ). Поскольку экспрессия Edar ограничена эпидермисом (рис. 5) A ), дермальная активация BMP4 и BMP7 должна быть косвенным эффектом.Интересно, что помимо увеличения общих уровней BMP, предполагается, что повышающая регуляция BMP7 в дермальном компартменте сделает возможным образование гетеродимеров BMP4 / 7, которые, как было показано, являются гораздо более мощными сигналами, чем гомодимеры BMP (28).
Рис. 5.Время транскрипционных событий, модель формирования паттерна и гиперактивация Эдара.( A ) Eda – / – Мутантные эксплантаты культивировали с Eda или без него с Noggin или без него в течение 4 часов, а экспрессию Edar , BMP4 и BMP7 определяли в отдельных эпидермисе и дерме. ( B ) Уровни экспрессии и локализация BMP в мутантной коже, культивированной с Eda в течение 10 часов. Индуцированная экспрессия BMP4 и BMP7 пунктирована. ( C ) Предполагаемые молекулярные взаимодействия, которые генерируют структуру первичных волосяных фолликулов.Сплошные линии указывают на автономные для клеток локальные взаимодействия, а пунктирные линии указывают на действия на расстоянии. ( D ) Иммуноокрашенные кератином 14 продольные срезы и окрашенные гематоксилином и эозином поперечные срезы дорсальной кожи 10-дневных трансгенных и нетрансгенных однопометников K14 :: LMP1-Edar. ( E ) Количественное определение плотности волосяных фолликулов в коже спины трансгенных и нетрансгенных мышей. Планки погрешностей показывают SEM.
На основании этих результатов мы предлагаем модель формирования паттерна первичных волосяных фолликулов (рис.5 C ), в котором наивный эмбриональный эпидермис равномерно экспрессирует молекулы, которые активируют (Eda и Edar) и ингибируют (BMP) идентичность волосяных фолликулов. Эдар подвергается локальной ауторегуляции и усилению сигнала, индуцирует CTGF и косвенно регулирует экспрессию BMP в дерме. Локальное ингибирование передачи сигналов BMP заставляет их действие на расстоянии репрессировать эпидермальный Edar и, следовательно, судьбу фолликула. Эти взаимодействия служат для усиления отклонений в начальных условиях для создания пространственно организованного массива фолликулов.
Мы стремились включить β-catenin в эту модель, потому что его активация важна для формирования паттерна фолликулов и морфогенеза (29). Мы проанализировали экспрессию Axin2 , гена-мишени прямого β-катенина (30), и обнаружили упорядоченный массив Axin2 -положительных очагов в эпидермисе WT E15. Eda – / – кожа имела случайные кластеры из этих Axin2 фокусов, что указывает на то, что некоторая точечная активность β-catenin присутствует в отсутствие передачи сигналов Edar.В культуре эти очаги подавлялись BMP и усиливались или стабилизировались Eda. Таким образом, некоторая предварительно запатентованная активность β-catenin оказывается независимой от функции Edar. Это наблюдение явно противоречит нашей модели, в которой функция Эдара регулирует решения о формировании паттернов. Одна возможность состоит в том, что эти фокусы Axin2 являются предполагаемыми местоположениями фолликулов, которые потенциально могут быть стабилизированы Эдаром. Чтобы определить, когда окончательный рисунок фолликулов станет фиксированным, мы разрезали культивированную кожу в разное время после применения Eda и искали выравнивание фолликулов по вновь сгенерированному краю.Краевые эффекты наблюдались, когда кожа подвергалась воздействию Eda в течение <10 ч, тогда как по истечении этого времени способность рисунка к изменению конфигурации в ответ на возмущение поля теряется (эти данные представлены на рис.6, который опубликован как вспомогательная информация на веб-сайте PNAS). Эти находки указывают на то, что лабильный препаттерн существует в отсутствие передачи сигналов Edar, но что требуется> 10 часов молекулярного согласования в присутствии Eda, чтобы зафиксировать окончательный паттерн.
Предлагаемая модель рассматривает ограничение активности Edar как решающее событие в формировании паттерна.Следовательно, он делает предсказание, что широко распространенная активация Edar должна привести к широко распространенному предположению о судьбе волосяного фолликула. Мы создали трансгенных мышей, экспрессирующих кДНК, состоящую из внутриклеточного домена Edar, слитого с трансмембранными доменами LMP1, вирусного белка, который передает лиганд-независимую передачу сигналов при слиянии с рецепторами на клеточной поверхности (31). Эта кДНК экспрессировалась в базальном слое эпидермиса с использованием промотора Keratin14. Три независимых мыши-основателя показали утолщенную чешуйчатую кожу, и из-за плохого состояния здоровья их пришлось убить в течение 20 дней после рождения.Разделение показало, что кожа этих животных была покрыта опущенными волосяными фолликулами, причем фолликулы плотно прилегали друг к другу, практически без промежутков между ними (рис. 5). D ). Количественное определение фолликулов в трансгенной коже спины показало, что она имеет плотность на ≈40% больше, чем у нетрансгенных однопометников (рис. E ). Это поколение сверхкомплектных фолликулов подтверждает важность ограничения передачи сигналов Edar в генерации соответственно структурированного массива волосяных фолликулов.
Обсуждение
Мы предлагаем управляемую рецептивностью модель образования волосяных фолликулов, в которой регуляция экспрессии Edar является ключевой. Другие системы активации-ингибирования, которые были изучены на молекулярном уровне, такие как определение разветвленной структуры пера (32) или лево-правой асимметрии позвоночных (33), полагаются на дифференциальные диффузионные свойства двух секретируемых лигандов. Напротив, модуляция реакции принимающей ячейки на широко доступный сигнал занимает центральное место в нашей модели.
Такие механизмы формирования паттерна основаны на разном диапазоне активирующих и ингибирующих молекул. Эдар и β-катенин ограничены клеткой, в которой они продуцируются, тогда как CTGF и BMP являются секретируемыми молекулами. Это свойство предполагает, что действие CTGF должно быть пространственно ограничено. Ограничение может быть достигнуто иммобилизацией CTGF на компонентах внеклеточного матрикса или диффузией комплексов CTGF-BMP с последующим высвобождением активных BMP. Наблюдение за тем, что мутантная и WT-эмбриональная кожа имеют одинаковые уровни экспрессии Edar (рис.1 B ) лучше всего объясняется тем фактом, что, хотя Eda активирует экспрессию Edar , он также индуцирует BMP s, которые подавляют Edar .
Используемый нами метод культивирования позволяет синхронизировать образование фолликулов и делает кожу доступной для экспериментальных манипуляций. Однако важно, чтобы наблюдения таких систем ex vivo коррелировали с результатами, полученными на интактных животных.В частности, применение рекомбинантных белков имитирует трансгенные подходы к усилению функции, тогда как эксперименты с потерей функции важны для понимания эндогенных функций. У целых животных устранение передачи сигналов Edar специфически блокирует образование первичных волосяных фолликулов (10), тогда как подавление активации β-катенина предотвращает образование всех типов фолликулов (29). В соответствии с ингибирующей ролью BMP в процессе формирования паттерна, делеция генов рецепторов BMP в эмбриональном эпидермисе вызывает увеличение плотности фолликулов к концу первичной волны образования фолликулов на E16 (34).Кроме того, делеция Noggin , предположительно приводящая к усилению передачи сигналов BMP, снижает количество волосяных фолликулов. Однако мутация Noggin специфически удаляет вторичные фолликулы, позволяя формироваться первичным фолликулам (14). Этот мутантный фенотип может указывать на то, что Noggin является основным ингибитором BMP, используемым вторичными фолликулами, чтобы избежать аутостимуляции BMP, в то время как первичные волосяные фолликулы вместо этого используют CTGF. Мыши CTGF -null демонстрируют аномалии скелета и умирают при рождении (35), но их кожный фенотип не описан.
В наших экспериментах манипулирование сигнальной активностью позволило модулировать плотности плакод в широком диапазоне, от 30 на квадратный миллиметр до 140 на квадратный миллиметр. Эта пластичность, а также выравнивание фолликулов вдоль границы рассеченных эксплантатов кожи указывает на то, что их конечные местоположения не были определены в мутантной коже Eda . Однако мы действительно обнаружили спорадическую экспрессию Axin2 , что свидетельствует о паттернированной активности β-катенина в отсутствие Eda.Эти очаги могут быть теми же клетками, которые были недавно идентифицированы как инициирующие, но неспособные поддерживать очень ранний морфогенез фолликулов в мутантной коже Edar (36). Податливость положения фолликула в ответ на экспериментальное возмущение предполагает, что этот препаттерн не обязательно представляет собой окончательный набор волосяных фолликулов. Axin2 -экспрессирующие очаги могут быть «предполагаемыми» местоположениями фолликулов, которые становятся фиксированными или иным образом, поскольку функция Edar ограничена в коже. Хотя взаимосвязь между β-catenin и Edar еще предстоит полностью выяснить, одной из связей между этими сигнальными модулями является обнаружение того, что BMP ингибирует образование фокусов Axin2 , тогда как Edar подавляет ответы BMP.Таким образом, Эдар может косвенно усиливать функцию β-катенина, защищая его от действия BMP. Плакоды, индуцированные Noggin в коже мутанта Eda (рис. D ) может представлять собой такую стабилизацию Axin2 фокусов.
Повышающая регуляция Edar , наблюдаемая в ранних плакодах, вероятно, влияет на его сигнальные свойства, что иллюстрируется его сверхэкспрессией под контролем нативных регуляторных элементов в линии OVE951. Способность умеренно повышенных уровней рецепторов компенсировать дефицит Eda предполагает, что повышающая регуляция рецепторов обеспечивает передачу сигналов, не зависящую от лиганда.Таким образом, аутоактивация экспрессии Edar , которая обычно происходит в ранних плакодах, может быть достаточной, чтобы позволить Eda-независимую передачу сигнала, помогая установить приверженность судьбе фолликула. Наша модель предсказывает, что эктопические фолликулы в этом случае не образуются, несмотря на автономную передачу сигналов Edar, потому что его экспрессия остается чувствительной к ингибированию BMP. Линия K14: LMP1-Edar была сконструирована так, чтобы иметь независимую от лиганда передачу сигналов, но дала гораздо более драматический фенотип формирования эктопических фолликулов.Это наблюдение соответствует нашей модели, потому что экспрессия, управляющая промотором, не подвержена подавлению BMP. Кожа этой трансгенной линии по существу не имеет рисунка в том смысле, что фолликулы просто заполняют все доступное пространство, а не пространственно регулируют свое расположение. Фенотип, индуцированный Эдаром, контрастирует с эффектами широко распространенной трансгенной активации β-катенина, которая вызывает рост новых фолликулов только в коже взрослых мышей, но не приводит к образованию эктопических фолликулов в эмбриональном периоде (37).Это открытие предполагает, что ограничение активации β-catenin не ограничивает определение местоположения волосяных плакод, хотя его активность явно необходима для образования фолликулов.
В этой работе мы обеспечиваем основу для построения других факторов, участвующих в развитии волосяных фолликулов, поскольку их отношения с путями Edar и BMP не раскрыты. В более широком смысле, вероятно, что вариации этой молекулярной сети лежат в основе формирования паттерна в развитии чешуек и перьев, а также в формировании морфологии зубов.Кроме того, наши находки эпидермально-дермальной коммуникации с самых ранних стадий формирования паттерна указывают на решающую роль обеих тканей и противоречат простому мнению, что позиционная информация сначала генерируется в дерме, а затем передается в пассивный эпидермис.
Методы
Животные.
WT, Eda Ta / Ta и Edaradd cr / cr строк находились на фоне FVB / N.Трансгенных животных OVE951 использовали для обнаружения Edar путем гибридизации in situ . Eda находится на Х-хромосоме; для краткости Eda – / – используется в тексте для обозначения женского пола Eda – / – и вилка Eda – / Y животных. Для спариваний по времени день, когда была обнаружена вагинальная пробка, засчитывался как день 0.K14: Трансгенных мышей LMP1-Edar получали, как описано (38).
In situ Гибридизация.Образцы фиксировали в 4% параформальдегиде в PBS в течение ночи при 4 ° C. Гибридизацию проводили, как описано (39). In situ гибридизации были сфотографированы, и плотность фолликулов была определена путем подсчета количества Shh -экспрессирующих фокусов в квадрате со стороной 1 мм. Для определения плотности каждого фолликула использовали данные по крайней мере трех независимых культур эксплантатов кожи.Края кожи в анализ не включались. Полоски учитывались как единый фолликул.
КПЦР.
РНКподвергали обратной транскрипции с использованием случайных праймеров и обратной транскриптазы AMV (Roche) в реакционной смеси объемом 20 мкл. Реакции разбавляли в 10 раз, и 5 мкл использовали в качестве матрицы для каждой количественной ПЦР. Зонды TaqMan были предоставлены Applied Biosystems. Использовались следующие зонды: β Актин (4352341E), BMP2 (Mm01962382_s1), BMP4 (Mm00432087_m1), BMP7 (Mm00432102_m1), 902 (Mm00432102_m1), 902_m1 Keratin14 (Mm00516876_m1), Noggin (Mm00476456_s1), Smad7 (Mm00484741_m1) и Sostdc1 (Mm00840254_m1).Двадцать микролитровых реакций проводили в трех экземплярах с использованием термоциклера OpticonII, используя по меньшей мере три биологических повтора для определения каждой точки данных. Мы не наблюдали изменений в общем количестве экспрессии β актина при различных экспериментальных обработках. Для каждого эксперимента контрольные и обработанные образцы были из одного помета. Относительные или абсолютные количества нормализатора и тестовых транскриптов рассчитывали по стандартной кривой.
Культура и лечение органов кожи.
Кожу на спине иссекали, помещали на фильтр MF-Millipore на металлической сетке и погружали в DMEM плюс 5% FBS в чашке с центральными лунками (Falcon) при 37 ° C и 5% CO. 2 . Эпидермально-кожное разделение проводили путем инкубации образцов кожи при 37 ° C в течение 10 минут с диспазой 2 мг / мл (GIBCO). Ткани гомогенизировали в реагенте TRI (Sigma) для выделения общей РНК и белков. Рекомбинантный EdaA1 (17) использовали в концентрации 50 нг / мл для in situ, гибридизации и гистологии и в концентрации 1000 нг / мл для анализа транскрипционных мишеней с помощью кПЦР.Рекомбинантные BMP и EGF использовали в концентрации 500 нг / мл, а Noggin использовали в концентрации 1000 нг / мл. BMP2 человека, BMP4 человека, BMP7 человека, EGF мыши и белки Noggin мыши были получены от R&D Systems. Для экспериментов с одновременной обработкой Noggin культуры предварительно обрабатывали Noggin в течение 2 часов перед добавлением Eda. BAY 11-7082 (Calbiochem) использовали в концентрации 20 мкМ.
Гистология и иммуногистохимия.
Образцы фиксировали в 4% параформальдегиде в PBS при 4 ° C в течение ночи, а затем обезвоживали и заливали парафином.Шестиметровые срезы окрашивали гематоксилином и эозином, 1/1000 FITC-конъюгированным анти-Keratin14 (Covance) или 1/100 кроличьим анти-фосфо-Smad1 / 5/8 (Cell Signaling Technology). Первичные кроличьи антитела детектировали с использованием 1/200 биотинилированных козьих антител против кроликов (Upstate Biotechnology) и пероксидазы ABC (Vector Laboratories).
Вестерн-блоттинг.
Пробы белка обрабатывали на 12% SDS / полиакриламидном геле и переносили на нитроцеллюлозную мембрану.Блоты блокировали в 5% обезжиренном молоке в TBS / 0,1% Tween 20 в течение 1 часа, а затем зондировали первичными антителами [1/25000 мышиных моноклональных анти-β Actin -пероксидазы конского редиса AC-15 (Sigma), 1/1 000 антибиотиков. -фосфо-Smad1 / 5/8 и 1/2 000 мышиных анти-фосфо-IκBα 5A5 (технология передачи сигналов клеток)] в TBS / 0,1% Tween 20 в течение ночи. Сигнал детектировали с использованием вторичных антител, конъюгированных с пероксидазой хрена, и хемилюминесцентного субстрата.
Благодарности
Благодарим С.M. Chuong, M. Dixon, D. Garrod, E. Harris, A. Hurlstone, H. Meinhardt, C. Thompson и R. Widelitz. Работа поддержана грантом Wellcome Trust Grant 075220 / Z.
Сноски
- § Кому следует направлять корреспонденцию. Эл. адрес: denis.headon {at} manchester.ac.uk
Вклад авторов: C.M., P.S., P.A.O. и D.J.H. спланированное исследование; К.М., Б.Дж. и Д.J.H. проведенное исследование; P.S. внесены новые реагенты / аналитические инструменты; СМ. и Д.Дж. проанализированные данные; и К. и Д.Дж. написал газету.
Заявление о конфликте интересов: о конфликте интересов не сообщалось.
Этот документ был отправлен напрямую (Трек II) в офис PNAS.
- Сокращения:
- BMP,
- костный морфогенетический белок;
- CTGF,
- фактор роста соединительной ткани;
- Eda,
- эктодисплазин; ,
- Edar, ,
- рецептор Eda;
- Эдарад,
- Эдар-связанный домен смерти;
- кПЦР,
- количественная ОТ-ПЦР;
- En,
- эмбриональный день n.
Сокращения:
- © 2006 Национальная академия наук США
Как хронический стресс приводит к выпадению волос
Исследователи HSCI определили механизм регенерации стволовых клеток волосяных фолликуловДжессика Лау
Исследователи Гарвардского института стволовых клеток (HSCI) определили биологический механизм того, как хронический стресс повреждает стволовые клетки волосяного фолликула, подтверждая давние наблюдения, что стресс может привести к выпадению волос.
В исследовании на мышах, опубликованном в журнале Nature, исследователи обнаружили, что главный гормон стресса заставляет стволовые клетки волосяного фолликула оставаться в длительной фазе покоя, не регенерируя волосяной фолликул и волосы. Исследователи определили конкретный тип клеток и молекулу, отвечающую за передачу сигнала стресса стволовым клеткам, и показали, что этот путь потенциально может быть направлен на восстановление роста волос.
«Моя лаборатория заинтересована в понимании того, как стресс влияет на биологию стволовых клеток и биологию тканей, отчасти благодаря тому факту, что каждый может рассказать историю о том, что происходит с его кожей и волосами, когда они находятся в состоянии стресса.Я понял, что как биолог, специализирующийся на стволовых клетках кожи, я не могу дать удовлетворительный ответ относительно того, действительно ли стресс оказывает влияние – и, что более важно, если да, то каковы механизмы », – сказал Я-Чие Сюй, доктор философии, Элвин и Эста Стар доцент кафедры стволовых клеток и регенеративной биологии в Гарварде и главный преподаватель ИСКЧ. «Кожа представляет собой управляемую и доступную систему для глубокого изучения этой важной проблемы, и в этой работе мы обнаружили, что стресс действительно задерживает активацию стволовых клеток и коренным образом меняет частоту регенерации тканей стволовыми клетками волосяного фолликула.”
Волосяной фолликул – одна из немногих тканей, которая может проходить этапы регенерации в течение жизни, и стала парадигмой, которая во многом определяет наше фундаментальное понимание биологии стволовых клеток млекопитающих. Волосяной фолликул естественным образом колеблется между ростом и отдыхом, и этот процесс поддерживается стволовыми клетками волосяного фолликула. Во время фазы роста стволовые клетки волосяного фолликула активируются для регенерации волосяного фолликула и волос, и волосы становятся длиннее с каждым днем. Во время фазы покоя стволовые клетки находятся в состоянии покоя, и волосы легче выпадают.Выпадение волос может произойти, если волосы выпадают, в то время как стволовые клетки остаются в покое без регенерации новой ткани.
В модели хронического стресса на мышах исследователи обнаружили, что стволовые клетки волосяных фолликулов очень долго оставались в фазе покоя, не регенерируя ткани. Главный гормон стресса, вырабатываемый надпочечниками, кортикостерон, был активирован хроническим стрессом; Обеспечение мышей кортикостероном позволило воспроизвести стрессовое воздействие на стволовые клетки. Эквивалентным гормоном у людей является кортизол, который также активируется при стрессе и часто называется «гормоном стресса».”
«Этот результат предполагает, что повышенный уровень гормонов стресса действительно оказывает негативное влияние на стволовые клетки волосяного фолликула», – сказал Хсу. «Но настоящее удивление произошло, когда мы исключили источник гормонов стресса».
В нормальных условиях регенерация волосяных фолликулов со временем замедляется – фаза покоя удлиняется с возрастом животных. Но когда исследователи удалили гормоны стресса, фаза покоя стволовых клеток стала чрезвычайно короткой, и они постоянно входили в фазу роста для регенерации волосяных фолликулов, даже когда животные были старыми.
«Таким образом, даже базовый уровень гормона стресса, который обычно циркулирует в организме, является важным регулятором фазы покоя. По сути, стресс просто поднимает эту уже существующую «ось надпочечник – волосяной фолликул», что еще больше затрудняет переход стволовых клеток волосяного фолликула в фазу роста для регенерации новых волосяных фолликулов », – сказал Хсу.
Установив связь между гормоном стресса и активностью стволовых клеток волосяного фолликула, исследователи искали биологический механизм, лежащий в основе этой связи.
«Сначала мы спросили, регулирует ли гормон стресса напрямую стволовые клетки, и проверили, отключив рецептор кортикостерона, но это оказалось неправильным. Вместо этого мы обнаружили, что гормон стресса на самом деле действует на кластер дермальных клеток под волосяным фолликулом, известный как дермальный сосочек », – сказал Секью Чой, доктор философии, ведущий автор исследования.
Известно, что дермальный сосочек имеет решающее значение для активации стволовых клеток волосяного фолликула, но ни один из ранее идентифицированных факторов, секретируемых дермальным сосочком, не изменился при изменении уровня гормона стресса.Скорее, гормон стресса не позволял клеткам кожных сосочков секретировать Gas6, молекулу, которая, как показали исследователи, может активировать стволовые клетки волосяного фолликула.
«И в нормальных, и в стрессовых условиях добавления Gas6 было достаточно для активации стволовых клеток волосяных фолликулов, которые находились в фазе покоя, и для стимулирования роста волос», – сказал Чой. «В будущем путь Gas6 может быть использован из-за его потенциала в активации стволовых клеток, способствующих росту волос. Также будет очень интересно изучить, связаны ли другие связанные со стрессом тканевые изменения с влиянием гормона стресса на регулирование Gas6.”
Эти первоначальные результаты на мышах необходимо дополнительно изучить, прежде чем их можно будет безопасно применить на людях. Управление технологического развития Гарварда защитило интеллектуальную собственность, относящуюся к этой работе, и изучает возможности сотрудничества по ее дальнейшему развитию и возможной коммерциализации.
В прошлом году группа Хсу обнаружила, как стресс влияет на другой тип стволовых клеток, расположенных в волосяном фолликуле, – на стволовые клетки меланоцитов, которые регенерируют пигмент волос.Исследователи обнаружили, что стресс активирует симпатическую нервную систему и истощает стволовые клетки меланоцитов, что приводит к преждевременному поседению волос. Теперь, в новом исследовании, два вывода вместе демонстрируют, что, хотя стресс оказывает пагубное влияние как на стволовые клетки волосяных фолликулов, так и на стволовые клетки меланоцитов, механизмы различны. Стресс истощает стволовые клетки меланоцитов напрямую через сигналы, полученные от нервов, в то время как стресс не позволяет стволовым клеткам волосяных фолликулов создавать новые волосы косвенно, через воздействие гормона стресса, производимого надпочечниками, на нишу.Поскольку стволовые клетки волосяного фолликула не истощаются, возможно, будет возможно реактивировать стволовые клетки в условиях стресса с помощью таких механизмов, как путь Gas6.
Помимо потенциального применения пути Gas6 для стимулирования роста волос, результаты исследования также имеют более широкое значение для понимания биологии систем органов.
«При поиске факторов, контролирующих поведение стволовых клеток, обычно мы ищем локально в коже. Несмотря на то, что существуют важные местные факторы, наши результаты показывают, что главный переключатель активности стволовых клеток волосяных фолликулов на самом деле находится далеко в надпочечниках и работает, изменяя порог, необходимый для активации стволовых клеток », – сказал Хсу.«Вы можете системно контролировать поведение стволовых клеток, находящихся в другом органе, который играет действительно важную роль, и мы изучаем все больше и больше примеров этих« межорганных взаимодействий ». Биология тканей взаимосвязана с физиологией тела. Нам все еще предстоит многому научиться в этой области, но наши открытия постоянно напоминают нам о том, что для понимания стволовых клеток в коже нам часто нужно думать не только о коже ».
Подробнее
Эта история была впервые опубликована на сайте Harvard Gazette 31 марта 2021 года.
Эта работа была частично поддержана New York Stem Cell Foundation, Smith Family Foundation Odyssey Award, Pew Charitable Trusts, Гарвардским институтом стволовых клеток, Гарвардской премией декана HMS, Американским онкологическим обществом, премией Джеймса и Одри Фостер MGH за исследования, NARSAD Young. Премия исследователя, Фонд MGH ECOR, Департамент здравоохранения штата Нью-Йорк и Национальные институты здравоохранения.
Исходная статья: Choi, S. et al. (2021 г.). Кортикостерон подавляет GAS6, чтобы управлять покоем стволовых клеток волосяного фолликула.Природа. DOI: 10.1038 / s41586-021-03417-2
Старение волосяного фолликула происходит за счет трансэпидермального удаления стволовых клеток посредством протеолиза COL17A1
Matsumura et al. проанализировали стволовые клетки волосяных фолликулов (HFSC) в коже мышей во время старения. Они предположили, что индуцированный повреждением ДНК протеолиз COL17A1 запускает трансэпидермальную элиминацию HFSC, что приводит к усадке волосяных фолликулов и выпадению волос.
Ранее мы показали, что CD34-положительные HFSC в коже мышей накапливают очаги повреждения ДНК во время физиологического старения (независимо от укорочения теломер), что приводит к дифференцировке стволовых клеток, но не к апоптозу или старению (1).Хронический геномный стресс, связанный со старением, имитировали, подвергая мышей C57BL6 ежедневному облучению в низких дозах (0,01 или 0,1 Гр) в течение нескольких недель, что приводило к постепенному накоплению сохраняющихся очагов повреждения ДНК с увеличением кумулятивных доз (1, 2). Анализ ультраструктуры очагов повреждения ДНК с помощью электронной микроскопии в сочетании с мечеными белками репарации ДНК показал, что накопление ассоциированных со старением очагов может отражать не постоянно не восстановленные DSB, а перестройки хроматина, вызванные репарацией или неправильным ремонтом повреждений ДНК (1).Сравнивая остаточные изменения хроматина в HFSC в стареющей и облученной коже, мы наблюдали, что их ультраструктурные размеры отражают сложность исходного генотоксического инсульта (вызванные окислительным стрессом однонитевые разрывы во время старения, двухцепочечные разрывы и более сложные повреждения ДНК после облучения). ), тем самым объясняя различные реакции на повреждение ДНК, что в конечном итоге приводит к различным биологическим результатам (1, 3). Мацумура и др. показали, что воздействие на кожу облучения в дозе 10 Гр вызывает устойчивое образование очагов повреждения ДНК в HFSC, даже у молодых мышей, и этот геномный стресс вызывает нарушение регуляции HFSC с протеолизом COL17A1.Примечательно, что эта чрезвычайно высокая доза не «точно имитирует физиологическое состояние старения HFSC», как предполагалось, но фактически вызывает серьезное повреждение кожи. В совокупности Мацумура и др. предполагают, что протеолиз COL17A1 является внутренним механизмом изменения стволовых клеток, которое запускает физиологическое старение. Однако протеолиз COL17A1, по-видимому, связан с динамическими изменениями в архитектуре ткани, необходимыми для устранения стрессовых клеток из пула стволовых клеток после различных типов повреждения кожи.
(1) Накопление изменений хроматина, вызванных повреждением ДНК, в тканеспецифичных стволовых клетках: движущая сила старения?
Schuler N, Rübe CE.
PLoS One. 2013 17 мая; 8 (5): e63932. DOI: 10.1371 / journal.pone.0063932. Печать 2013.
(2) Накопление повреждений ДНК в сложных нормальных тканях после продолжительного облучения малой дозой.
Schanz S, Schuler N, Lorat Y, Fan L, Kaestner L, Wennemuth G, Rübe C, Rübe CE.
Ремонт ДНК (Amst). 2012 1 октября; 11 (10): 823-32. DOI: 10.1016 / j.dnarep.2012.07.005. Epub 2012 1 сентября
(3) Наноразмерный анализ кластерных повреждений ДНК после облучения с высокой ЛПЭ с помощью количественной электронной микроскопии – тяжелое бремя восстановления.
Lorat Y, Brunner CU, Schanz S, Jakob B, Taucher-Scholz G, Rübe CE.
Ремонт ДНК (Amst). 2015 Апрель; 28: 93-106. DOI: 10.1016 / j.dnarep.2015.01.007. Epub 2015 28 января
Микробиом волосяного фолликула пациентов с андрогенной алопецией
Abstract
Андрогенетическая алопеция – наиболее частая форма облысения у мужчин.Это многофакторное состояние, связанное с генетической предрасположенностью и гормональными изменениями. Роль микрофлоры при выпадении волос еще предстоит выяснить. Поэтому мы проанализировали микробиом волосяных фолликулов у пациентов с выпадением волос и у здоровых людей. Волосяные фолликулы были извлечены из затылочной и вершинной области пациентов с выпадением волос и здоровых добровольцев и далее рассечены на средние и нижние отделы. Затем микробиом охарактеризовали секвенированием 16S рРНК. Отчетливая микробная популяция была обнаружена в среднем и нижнем отделах волосяных фолликулов.В среднем отделении волоса преобладали Burkholderia spp . и менее разнообразный; в то время как более высокое бактериальное разнообразие наблюдалось в нижней части волос. Затылочные и макушные волосяные фолликулы достоверных различий не имели. У пациентов с выпадением волос в миниатюрных макушках было повышено содержание Propionibacterium acnes в среднем и нижнем отделах, в то время как неминиатюрные волосы в других регионах были сопоставимы со здоровыми. Повышенная численность P . acnes в миниатюрных волосяных фолликулах может быть связано с повышенной экспрессией гена иммунного ответа в волосяном фолликуле.
Образец цитирования: Ho BS-Y, Ho EXP, Chu CW, Ramasamy S, Bigliardi-Qi M, de Sessions PF, et al. (2019) Микробиом волосяного фолликула пациентов с андрогенной алопецией. PLoS ONE 14 (5): e0216330. https://doi.org/10.1371/journal.pone.0216330
Редактор: Джэ-Хо Шин, Национальный университет Кёнпук, Республика Корея
Поступила: 5 марта 2019 г .; Одобрена: 19 апреля 2019 г .; Опубликовано: 3 мая 2019 г.
Авторские права: © 2019 Ho et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Данные доступны через Европейский нуклеотидный архив под номером доступа PRJEB22473.
Финансирование: Исследование поддержано Агентством по науке, технологиям и исследованиям в разработке дизайна исследования и сбора, анализа и интерпретации данных, а также в написании рукописи.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
Сокращения: PV, Вершина пациента; PO, больной затылочный; РЕЗЮМЕ, контрольная вершина; CO, контрольный затылочный; AGA, Андрогенетическая алопеция; PCoA, Анализ главных координат
Введение
Андрогенетическая алопеция (AGA) проявляется в прогрессирующей миниатюризации волос на коже головы, что приводит к появлению отчетливого узорчатого облысения у мужчин [1].Это наиболее распространенная форма выпадения волос у мужчин, вызванная генетической предрасположенностью с повышенной активностью андрогенов. Циркулирующий в крови тестостерон метаболизируется в более мощную форму – дигидротестостерон, который действует на дермальный сосочек волос, замедляя рост волос. Миниатюризация волос часто сопровождается разрушением мышцы-выпрямителя и гиперплазией сальных желез [2], что приводит к жирной поверхности и часто воспалению кожи головы в виде себорейного дерматита [3].Одновременно наличие инфильтрации лимфоцитов, активированных Т-клеток в облысении кожи головы и дегрануляции фолликулярных тучных клеток предполагает микровоспаление или иммунный ответ как причину или следствие процесса миниатюризации волос [4, 5]. Предполагается, что микровоспаление вызвано УФ-излучением, наличием микробов, , IL-6, и андрогенной сигнальной активностью [6].
Кожа и волосы человека являются местом обитания огромного разнообразия микроорганизмов, и установление равновесия имеет решающее значение для здоровья и болезненного состояния кожи и волос.Микробиом на поверхности кожи человека был тщательно изучен, как описано ранее [7, 8]; в то время как меньше работы было выполнено в дерме и волосяном фолликуле [9, 10]. При культивировании бактериальных колоний было обнаружено, что в волосяных фолликулах содержится 25% микробной популяции кожи [11]. Исследования секвенирования выявили существование микроорганизмов вплоть до дермы, в то время как волосяные фолликулы и эккринные железы содержат отдельные компартментарные микробные сообщества. Следовательно, есть большой потенциал в изучении микробиома волос, включая структуру волос.
Микробиом кожи состоит из комменсальных микробов и условно-патогенных микроорганизмов, которые постоянно взаимодействуют с хозяином, вызывая и уклоняясь от иммунных ответов хозяина. Участие микробной активности в заболеваниях кожи и волос было показано в нескольких случаях. Staphylococcus aureus обычно обнаруживается в поражениях кожи [12], и его чрезмерное присутствие было связано с атопическим дерматитом, хроническими диабетическими ранами и псориазом [13-15]. Грибковая инвазия в выпуклость волосяного фолликула приводит к необратимому выпадению волос и рубцеванию, например, при Tinea Capitis.Присутствие дрожжей, таких как виды Malassezia , связано с повышенным выпадением волос [16], образованием перхоти [17], а также с одной из причин обострения атопического дерматита (как описано в [18]). Распространенность Propionibacterium acnes связана с патогенезом вульгарных угрей [19], и сообщалось о случаях появления волосков и алопеции [20]. Роль микроорганизмов в AGA остается неизвестной. Мы сообщаем о первом исследовании микробиома в среднем и нижнем отделе волос у здоровых пациентов и пациентов с AGA, чтобы понять возможную связь с прогрессированием AGA.
Результаты
Структуры фолликулярной биопсии пациента и контрольной группы
Используя секвенирование с использованием дробовика 16S, мы определили микробиом в средней и нижней частях затылочных и вершинных волосяных фолликулов у 20 пациентов и 10 контролей. Образцы здоровых волос были взяты из затылочной и макушной областей здоровых добровольцев и из не облысевшей затылочной области пациентов с помощью ударов 1 мм (рис. 1А). Образцы, взятые из областей лысеющих вершин пациентов, демонстрировали признаки «миниатюризации» с измененной морфологией укороченного и истонченного стержня волоса длиной менее 3 см (рис. 1B и рис. S1) [21].Поэтому волосяные фолликулы короче 3,2 см в этом исследовании были классифицированы как миниатюрные. Рассечение фолликулярной единицы выполнялось для получения микробиома из нижней, средней и верхней части фолликула. В неминиатюрных образцах нижняя часть содержит луковицу волос и небольшое количество окружающих подкожных и кожных тканей; в то время как миниатюрные образцы дали большую биомассу, включая окружающие ткани кровеносных сосудов, нервных окончаний и потовых желез, благодаря методу отбора проб биопсии.Биопсия средней части содержала выпуклость волос, жировую ткань и соединительные ткани дермы (рис. 1C – 1F).
Рис. 1. Морфология и гистология FUE, использованного в исследовании секвенирования.
(A) Репрезентативное изображение участков взятия проб затылочной (o) и вершинной (v) областей у пациентов (p) и контрольной группы (c). (B) Миниатюрные и неминиатюрные волосяные фолликулы у пациентов с AGA. Пунктирными линиями обозначены участки рассечения фолликулярных единиц на верхнюю (U), среднюю (M) и нижнюю (L) части.Масштаб: 0,5 см. Репрезентативное гистологическое изображение (C-D) средней части и (E-F) нижней части неминиатюрных и миниатюрных образцов. A: жировая ткань, BV: кровеносный сосуд, C: соединительная ткань, E: эккринная железа, N: нерв, S: стержень волоса, Масштаб: 100 мкм.
https://doi.org/10.1371/journal.pone.0216330.g001
Профиль микробиома из выборки
Микробиом кожи может значительно различаться на разных участках тела у человека и у разных людей [10, 22].Используя анализ несходства Брея-Кертиса, мы обнаружили относительно низкий уровень несходства в микробном профиле между и внутри индивидуально, что подразумевает низкие вариации внутри наших пациентов и контрольной группы, а также между волосяными фолликулами в затылочной и вершинной областях (рис. 2А). Используя индексы Шеннона и Симпсона, альфа-разнообразие было значительно больше в выборках из нижней части, чем в выборках из средней части (p <0,005; рис. 2B). Анализ филогенетических расстояний с невзвешенным Unifrac выявил уникальные и отдельные кластеры между образцами фолликулов из нижней и средней частей, что позволяет предположить наличие различных микробных популяций в этих двух (рис. 2C).
Рис. 2. Профили микробиома нижней и средней частей FUE от пациентов с AGA и здоровых людей из контрольной группы.
(A) Расстояния Брея-Кертиса, отображающие различие между образцами и внутри образцов из затылочной и вершинной областей. (B) Видовое богатство образцов из нижней и средней частей, как показано индексами альфа-разнообразия Шеннона и Симпсона (U-критерий Манна-Уитни, p <0,005). (C-E). Невзвешенный анализ главных координат UniFrac (PCoA) всех образцов, (C) с цветовой кодировкой нижней и средней части образца; (D) образцы из средней части, отмеченные цветом в зависимости от степени миниатюризации; (E) и образцы из нижней части, отмеченные цветом в зависимости от степени миниатюризации.
https://doi.org/10.1371/journal.pone.0216330.g002
Для наблюдения за различиями микробиоты в волосах пациентов и контрольных волос мы выполнили PCoA на образцах средней и нижней части соответственно. В образцах из средней части большинство неминиатюрных образцов образовали плотный, отчетливый кластер из миниатюрных образцов (рис. 2D), что указывает на последовательную и однородную колонизацию в средней фолликулярной части независимо от ее вершинного или затылочного происхождения.Образцы из нижней части демонстрируют более высокую степень вариации между пациентами и здоровыми людьми из контрольной группы, в то время как миниатюрные образцы последовательно сгруппированы независимо от неминиатюрных образцов (рис. 2E), что указывает на различия между их соответствующими микробными сообществами (рис. 2D и 2E). Соответственно, классификация образцов в соответствии с их происхождением показала тесную кластеризацию контрольных образцов затылочной части, вершины с образцами затылочной части пациента, в то время как ряд образцов вершины пациента как выбросы (рис. S2A).Однако классификация по возрасту пациентов и тяжести AGA не дала четкого шаблона кластеризации (S2B и S2C, рис.).
Члены микробного сообщества в средних, нижних и миниатюрных образцах были похожи. Однако относительная численность каждого члена и их соответствующие роды колонизации различались между каждой группой и индивидуумом (рис. 3, таблица S1). Средняя часть неминиатюрных пациентов и контрольная группа была преимущественно колонизирована Burkholderia spp . (68,1–87,9%) (рис. 3A, таблица 1A) В пределах родов Burkholderia , B . заражает (идентификатор GenBank: CP013390.1) и B . cepacia (идентификатор GenBank: AB211225.1) были основными идентифицированными видами, наряду с B . cenocepacia , B . kururiensis , и они были взаимоисключающими в каждом волосяном фолликуле, и мы не обнаружили очевидной корреляции с тяжестью AGA, областью или компартментом волосяного фолликула для распределения различных видов (таблица S2). Более разнообразный микробиом находится в нижней части с преобладающими видами Brevibacterium (34.5–41,0%), Methylobacterium komagatae (20,7–25,5%), Sphingomonas (3,5–6,6%) (рис. 3B, таблица 1B).
Рис. 3. Таксономическая относительная численность по выборкам.
Гистограмма с накоплением, отображающая средние относительные количества в образцах пациентов и контрольных образцов, полученных из (A) средней части и (B) нижней части неминиатюрных образцов. (C) Относительное количество нижних и средних частей от миниатюрных образцов вершины пациента. Относительная численность представлена в соответствующих таксономических рангах – g: роды; f: Семья; o: Заказ; k: Королевство.
https://doi.org/10.1371/journal.pone.0216330.g003
Четкий рисунок облысения при AGA формируется прогрессирующей миниатюризацией фолликулов и последующим облысением на макушке, в то время как волосяные фолликулы в затылочной области остаются типичными. Чтобы изучить связь микробиоты с фенотипом, были выполнены попарные сравнения PERMANOVA между затылочной и вершинной областями пациентов и контрольной группы (таблица 2). В целом, относительная численность различных родов в макушке пациента (PV) значительно отличалась от контрольных образцов затылочной (CO) и контрольной вершин (CV) в средней и нижней частях (значение P <0.05) (Таблица 2А). Мы повторили PERMANOVA с удаленными миниатюрными образцами, что не привело к существенной разнице в сравнении (Таблица 2B), предполагая, что изменение микробиоты в основном связано с миниатюризацией волос. Сравнение микробиоты в миниатюрных и неминиатюрных образцах вершины пациента показало, что в средней части P . acnes Обилие увеличилось с уменьшением Burkholderia spp. избыток; а M . komagatae , Sphingomonadaceae и Brevibacterium были уменьшены в нижней части (таблицы 3A и 3B, рисунки 3 и 4). Кроме того, нижняя часть РО значительно отличалась от СО; мы обнаружили, что P . acnes численность увеличилась со значимостью, тогда как численность Brevibacterium снизилась (таблица 3C, рис. 3 и 4).
Рис. 4. Репрезентативная численность бактерий в образцах волос.
(А) П . acnes и (B) Burkholderia spp . обилие образцов волос из разных регионов происхождения и миниатюризации. (C) Brevibacterium и (D) Methylobacterium изобилие в образцах волос из разных регионов происхождения.
https://doi.org/10.1371/journal.pone.0216330.g004
Сообщается, что P . acnes и жилая микрофлора волос и кожи могут вызывать врожденный иммунный ответ посредством толлин-подобного рецептора 2 ( TLR2 ) и усиления антимикробных пептидов, включая β-дефенсин ( DEFB1 ) [23, 24].Посредством секвенирования РНК образцов нижней части подмножества было обнаружено, что несколько генов в представлении антигена и воспалительных путях Th-1, Th-2 повышены в миниатюрных волосяных фолликулах [25, 26]. Таким образом, мы проанализировали транскриптомную экспрессию генов, участвующих в микробном ответе, уровень экспрессии генов, участвующих в ответах на микробы, такие как Toll Like Receptor-2 ( TLR2 ), DEFB1 , фактор регуляции интерферона 1 ( IRF1 ), моноцитарный маркер CD14 и маркер клеток Лангерганса CD1a / CD207 были увеличены в миниатюрных волосяных фолликулах по сравнению с неминиатюрными [27–29] (Рис. 5).Эти изменения предполагают, что повышенный иммунный ответ и инфильтрация иммунных клеток соответствовали увеличению P . угорь изобилие.
Рис. 5. Экспрессия генов иммунного ответа в миниатюрных и неминиатюрных волосяных фолликулах.
Гистограммы, отображающие количество считываний TLR2 , IRF1 , DEFB1 , CD1A и CD14 в миниатюрных и неминиатюрных образцах вершин, соответствующих пациенту, данные представлены в виде среднего значения ± SEM.* P-значение <0,05.
https://doi.org/10.1371/journal.pone.0216330.g005
Обсуждение
Микробное сообщество на поверхности кожи хорошо охарактеризовано, в то время как о микросреде волосяного фолликула известно меньше. В литературе анализировалась микробиота из вырванных образцов волос или целых волосяных фолликулов с участков кожи [9, 10]. Эти исследования дают представление о профиле фолликулярной микробиоты в когорте азиатских мужчин в Сингапуре (n = 30).Согласно литературным данным, в дерме и дермальных участках волосяного фолликула можно обнаружить разнообразное микробное сообщество и образование бактериальных биопленок [10, 30]. Обилие бактерий в средней части может быть связано с непосредственной близостью к поверхности кожи с богатой микрофлорой. Более высокое бактериальное разнообразие в нижней части является неожиданным, но может играть более важную роль в патогенезе волос из-за плотной сосудистой сети вокруг волосяного сосочка и, следовательно, большего количества потенциальных взаимодействий с иммунной системой хозяина.Это может означать сложное взаимодействие с иммунным ответом хозяина. Интересно, что в отличие от предыдущих отчетов, в нашем исследовании мы не наблюдали значительных межличностных вариаций микробиоты [10, 31]. Мы также сообщаем о немного отличной бактериальной популяции от других исследований, такие различия могут происходить из-за метода сбора образцов; поскольку волосяной фолликул извлекается в стерильных условиях с помощью биопсии волосяного фолликула с прилегающей тканью (кровеносные сосуды, нервные волокна, соединительная ткань и сальные железы), в то время как другие использовали микроскопию с лазерным захватом или выщипывание волос.
Несколько этапов от сбора образцов до анализа результатов являются неотъемлемой частью исследований микробиома кожи [32]. Во время сбора образцов кожа головы пациентов подвергалась дезинфекции перед извлечением фолликулярных единиц, тем самым удаляя потенциальное загрязнение бактериями на поверхности кожи. Кроме того, выбор праймера может повлиять на результаты секвенирования. Сообщалось о различии в представлении Propionibacterium и Staphylococcus с праймерами, нацеленными на гипервариабельную область V1-V3 и область V3-V4 [33].Другие исследования показали, что область V3-V4 может точно представлять микробиом кожи [34, 35]. Мы использовали праймеры, амплифицирующие области V3-V6 на 16S рРНК, чтобы улучшить таксономическое разрешение с более длинными ампликонами, и ожидаем, что смещение в сторону определенных родов будет минимальным [36]. Было отмечено, что влияние загрязнения реагентов на анализ микробиома искажает распределение и частоту идентифицированных видов бактерий [33, 37]. Чтобы решить эту проблему, мы включили элементы управления без шаблонов в анализ секвенирования.В результате количество считываний было меньше порогового значения для последующего анализа, что обеспечило качество результатов исследования.
В соответствии с исследованиями с использованием образцов кожи головы и выщипанных волос, представители рода Burkholderia были обнаружены в большом количестве в образцах фолликулов из средней части [9, 10]. Burkholderia cepacia и Burkholderia contaminans были изолированы от пациентов с муковисцидозом и пневмонией, однако не было известно, что это связано с кожными заболеваниями [38, 39].Доминирующие виды на поверхности кожи, такие как Propionibacterium , Corynebacterium и Staphylococcus , встречались в этом исследовании с низкой частотой, что может отражать предпочтение обитания на поверхности кожи над более глубокими слоями кожи. Микробиом кожи продемонстрировал топографическую изменчивость в зависимости от физиологии кожи в местах отбора проб, включая влажность, температуру и pH; оставаясь относительно стабильным во времени [31, 40–42]. Затылочная часть и макушка черепа могут представлять микробиому различную микросреду кожи, поскольку они происходят из разных пластин эмбрионального развития и подвергаются воздействию солнечного излучения различной степени.Пациенты с AGA обычно имеют узорчатое облысение, при котором более низкая густота волос, истончение волос и желтые точки, изображающие увеличенные сальные железы в ответ на андроген, очевидны в области макушки черепа [43, 44]. Несмотря на изменения, микробиом у пациентов с AGA существенно не отличался между разными участками кожи головы; он также не был уникальным в зависимости от индивидуального возраста и степени тяжести AGA. Скорее, в этом исследовании наблюдались отчетливые микробные профили из миниатюрных образцов волос.Данные показывают, что изменения, специфичные для миниатюризации волос, могут вызвать нарушение микробиома. Кроме того, нижние части неминиатюрных образцов содержат чистые волосяные луковицы, в то время как миниатюрные образцы могут включать окружающие ткани, включая потовые железы и кровеносные сосуды, в которых могут находиться существенно разные популяции микробов. Однако увеличилась численность P . acnes можно было наблюдать в средней части миниатюрных и неминиатюрных образцов, где они имели сходную гистологию с сальными железами и жировой тканью.Необходимо провести дальнейшие исследования для изучения конкретных изменений миниатюрных волос, связанных с P . угорь изобилие.
Давно предполагалось, что P . acnes участвует в патогенезе АГА [6, 45, 46]. В нашем исследовании мы впервые сообщаем о таком поразительном увеличении количества миниатюрных волос. П . acnes – распространенный условно-патогенный микроорганизм, обнаруживаемый на поверхности кожи, он преобладает в волосяном фолликуле и связанном с ним волосяном покрове [47, 48]. П . acnes Преобладание также идентифицируется в непораженной коже черепа пациентов с себорейным дерматитом [49]; обеспечение дальнейшей поддержки развития гиперплазии сальных желез при AGA может привлекать пролиферацию P . acnes ; ведь липиды и жирные кислоты являются его основными источниками питательных веществ [50]. В качестве альтернативы, как и в случае обыкновенных угрей, другого заболевания, связанного с метаболизмом тестостерона, предполагается, что изменение состава кожного сала с увеличением перекисного сквалена приводит к P . acnes пролиферация [51–53], и такие изменения могут происходить в AGA. П . acnes вызывает воспалительные реакции и известен как один из причинных факторов acnes vulgaris . Доказано, что вирулентность в волосяном фолликуле вызывает образование слепков и, как следствие, выпадение волос [20]. Дополнительно интересно отметить увеличение P . acnes изобилие в образцах с затылочной части, что указывает на возможность того, что увеличение кожного сала на окружающей среде кожи головы может привести к изменениям в микробиоме кожи головы.Кроме того, филогенетический анализ показал, что P . acnes состоит из четырех отдельных линий; каждый демонстрирует различия в индукции воспалительных реакций и детерминантах вирулентности [54, 55]. Дальнейшая характеристика уровня штамма будет важна для расшифровки его роли в патогенезе AGA.
Признаки микровоспаления, такие как перифолликулярная воспалительная инфильтрация, повышение простагландинов и цитокинов, наблюдались в волосяных фолликулах пациентов с AGA и, как предполагается, вызывают миниатюризацию волос [6, 56, 57].Считается, что сочетание факторов окружающей среды, включая УФ-излучение, воздействие аллергенов и выработку порфирина, вызывает воспаление [46, 58], при этом считается, что воспалительные факторы препятствуют росту волос. Наши данные о наличии Р . acnes добавляет факторы, способствующие микровоспалению при выпадении волос. Недавние исследования, посвященные изучению иммунных взаимодействий микробиома и хозяина, предполагают, что микробиом индуцирует продукцию воспалительных цитокинов в кишечнике хозяина и снижает функцию Т-лимфоцитов в коже мышей [59, 60].Присутствие клеток Лангерганса также указывает на индукцию врожденного иммунного ответа, поскольку они в основном участвуют в презентации антигена. Эти данные указывают на то, что микробиом может играть более важную и сложную роль, чем предполагалось ранее. Интересно, что сообщения об эффективном лечении AGA антимикробными растворами и кетоконазолом [61, 62] предполагают участие микроорганизмов в AGA, помимо его антиандрогенных свойств. Помимо генетических причин AGA, P . acnes может действовать как фактор окружающей среды для патогенеза AGA и представляет нового кандидата в лечении AGA. Будущие исследования влияния изменений на другие виды бактерий и дисбаланса не менее важны для расшифровки патогенеза AGA. Поскольку волосяные фолликулы можно разделить на выпуклость, матрикс и дермальный сосочек, важно визуализировать распределение микробиома волосяного фолликула с большей четкостью по отсекам. Дополнительная информация поможет понять связь между микробиомом и состоянием волос.
Заключение
Мы сообщили о различных микробных популяциях в средней и нижней части волосяного фолликула. Род Burkholderia преобладает в средней части, в то время как более высокое микробное разнообразие наблюдалось в нижней части. У пациентов с AGA уменьшенные волосы на макушке пациентов были выше P . угрей , в то время как волосы из других регионов были сопоставимы. Это первое исследование микробиома AGA, которое дает новое представление об этом состоянии.
Методы
Сбор образцов, выделение ДНК и секвенирование
Двадцать пациентов с AGA и 10 здоровых добровольцев были задействованы в ранее описанном исследовании [25]. Утверждение этических норм и согласие на участие были получены через Наблюдательный совет Национальной группы здравоохранения (NHG-DSRB «Анализ транскриптома и генома 2012/00488 биопсии кожи головы человека при андрогенной алопеции до и после местного лазерного лечения»). Все методы проводились в соответствии с утвержденным протоколом.После тщательной местной дезинфекции 70% изопропанолом были произведены экстракции фолликулярных единиц в макушной и затылочной областях пробойником диаметром 1,1 мм. Извлеченные фолликулярные единицы были визуализированы с помощью диссекционного микроскопа (Zeiss) с установленной цифровой камерой, а затем разделены на 3 части (волосяной сосочек, средняя часть с сальной железой и верхняя часть с устьем и эпидермисом) и немедленно заморожены в жидком азоте.
Чтобы оценить любые изменения популяции микробиома в волосяном фолликуле, ДНК была извлечена из нижней (волосяная луковица) и средней (вместе с сальными железами) части фолликулярной единицы.Образцы фолликулярных единиц подвергали измельчению (MP Biomedicals) и экстракции гДНК с использованием набора для экстракции РНК / ДНК AllPrep в соответствии с инструкциями производителя (Qiagen). ПЦР 16S рРНК проводили на образцах и дублировали контрольные образцы без матрицы с использованием праймеров, охватывающих области V3-V6, в условиях ПЦР, описанных ранее [36, 63]. Библиотеки секвенирования ДНК были созданы с помощью набора для библиотек ДНК QIAseq FX (96) (Qiagen). Библиотеки ДНК секвенировали по парным концам на Illumina HiSeq Rapid (2 × 76 пар оснований).После демультиплексирования (с использованием программного обеспечения Illumina bcl2fastq 2.17.1.14) и удаления считываний, которые не соответствовали фильтрам чистоты Illumina (PF = 0), считывания были преобразованы в FASTQ. Секвенирование 16S рРНК образцов дало в среднем 452 193 отсчета считывания, в то время как 4 образца и контрольные библиотеки без матрицы, которые дали менее 50 000 отсчетов считывания, были впоследствии отброшены. Обрезка чтений производилась путем удаления замыкающих баз с показателем качества ≤ 2; Также были удалены пары чтения с прочтениями короче 60 пар оснований.
Реконструкция последовательности ампликона 16S рРНК.
Чтобы восстановить последовательности ампликона 16S, мы использовали методы обработки, описанные в Ong et al [18). Обрезанные чтения были введены в EMIRGE (версия GIT 98787b5). EMIRGE выполняет «сборку» на основе шаблонов на основе модифицированной базы данных SILVA SSU (версия 102) и использует алгоритм максимизации ожидания для итерации, выравнивания и классификации считываний в последовательности-кандидаты 16S [64]. Итеративное отображение парных чтений также предотвращает отображение химерных последовательностей.Эту методологию реконструкции сравнивали с RTAX и modQIIME, и она смогла дать надежные высоко согласованные оценки таксономической численности OTU [18].
Мы применили EMIRGE к верхним (по среднему качеству) 500 000 считываний в каждой выборке; ранее мы обнаружили, что это число достаточно надежно, чтобы точно отражать состав 16S в каждом образце [18]. Последовательности с относительной численностью ниже 0,1% были удалены. Наконец, реконструированные последовательности ампликонов были отысканы с помощью BLAST по базе данных 16S рРНК Greengenes [65]. Попадания в BLAST были отсортированы в последовательном порядке: наименьшее значение E, наибольшая битовая оценка, наивысший процент идентичности и наибольшая длина выравнивания; для классификации использовалось только первое совпадение после этой сортировки.Процент идентичностей для уровней типа, семьи и рода составлял 75%, 86,5% и 94,5% соответственно.
Определение численности микробного сообщества.
Оценки численности были присвоены реконструированным последовательностям с использованием EMIRGE для создания профиля численности OTU для каждой выборки. Матрица данных, содержащая относительную численность, с каждой выборкой в виде строки и каждого рода в виде столбца, использовалась для создания столбчатых диаграмм относительной численности и прямоугольных диаграмм альфа-разнообразия с использованием программного обеспечения R версии 3.4.0. Анализ главных координат (PCoA) с расстоянием Брея – Кертиса был применен с использованием «веганского» пакета в R.
.Обработка проб и гистология
Диссектированные фолликулярные единицы фиксировали в 4% параформальдегиде. Образцы обезвоживали и заливали парафином для получения срезов толщиной 5 мкм. Окрашивание гематоксилином и эозином проводили на срезах волос и визуализировали с помощью Zeiss AxioImager (Zeiss).
Дополнительная информация
S2 Рис. Группирование образцов волос.
График PCoA средних (слева) и нижних (справа) образцов волос, помеченных в соответствии с (A) областью (сгруппированы в контрольную затылочную, вершинную и затылочную, вершину пациента) (B) Степень AGA (сгруппированы по шкале Norwood Hamilton 3–4 ; 5–6 и здоровые) (C) Возраст (контроль 20–40; 40–60 и пациент 20–40; 40–60). Образцы были отмечены номером образца.
https://doi.org/10.1371/journal.pone.0216330.s002
(PDF)
Список литературы
- 1. Гамильтон Дж. Б.Узорчатое облысение у мужчин: типы и частота. Летопись Нью-Йоркской академии наук. 1951; 53 (3): 708–28. pmid: 14819896
- 2. Торкамани Н., Руфау Н. В., Джонс Л., Синклер Р. Разрушение мышцы-арректора пилей и жировая инфильтрация при андрогенной алопеции. Британский журнал дерматологии. 2014. 170 (6): 1291–8. pmid: 24579818
- 3. Кибар М., Актан Ş, Билгин М. Результаты дерматоскопии кожи головы при андрогенной алопеции и их связь с тяжестью заболевания.Летопись дерматологии. 2014; 26 (4): 478–84. pmid: 25143677
- 4. Латтананд А., Джонсон В. Облысение по мужскому типу – гистопатологическое и гистохимическое исследование. Журнал кожной патологии. 1975. 2 (2): 58–70. pmid: 777055
- 5. Яворский С., Клигман А.М., Мерфи Г.Ф. Характеристика воспалительных инфильтратов при облысении по мужскому типу: значение для патогенеза. Британский дерматологический журнал. 1992. 127 (3): 239–46. pmid: 13
- 6. Mahé YF, Michelet JF, Billoni N, Jarrousse F, Buan B, Commo S и др.Андрогенетическая алопеция и микровоспаление. Международный журнал дерматологии. 2000. 39 (8): 576–84. pmid: 10971723
- 7. Грайс Э.А., Сегре Я. Микробиом кожи. Обзоры природы микробиологии. 2011; 9 (4): 244. pmid: 21407241
- 8. Kong HH. Микробиом кожи: основанное на геномике понимание разнообразия и роли микробов кожи. Тенденции молекулярной медицины. 2011. 17 (6): 320–8. pmid: 21376666
- 9. Тридико С.Р., Мюррей, округ Колумбия, Эддисон Дж., Киркбрайд К.П., Банс М.Метагеномный анализ бактерий на человеческих волосах: качественная оценка для применения в судебной медицине. Следственная генетика. 2014; 5 (1): 16. pmid: 25516795
- 10. Накацудзи Т., Чан Хи, Цзян С.Б., Нагараджан Х., Зенглер К., Галло Р.Л. Микробиом простирается до субэпидермальных отделов нормальной кожи. Связь природы. 2013; 4: 1431. pmid: 23385576
- 11. Lange-Asschenfeldt B, Marenbach D, Lang C, Patzelt A, Ulrich M, Maltusch A и др. Распространение бактерий в эпидермальных слоях и волосяных фолликулах кожи человека.Фармакология и физиология кожи. 2011; 24 (6): 305–11. pmid: 21757977
- 12. ЛЕЙДЕН JJ, MARPLES RR, KLIGMAN AM. Золотистый стафилококк при поражении атопическим дерматитом. Британский журнал дерматологии. 1974; 90 (5): 525–. pmid: 4601016
- 13. Kong HH, Oh J, Deming C, Conlan S, Grice EA, Beatson MA и др. Временные сдвиги в микробиоме кожи, связанные с обострениями болезни и лечением у детей с атопическим дерматитом. Исследование генома. 2012; 22 (5): 850–9.pmid: 22310478
- 14. Гао З., Цзэн Ч., Стробер Б.Э., Пей З., Блазер М.Дж. Существенные изменения кожной бактериальной биоты при псориатических поражениях. ПлоС один. 2008; 3 (7): e2719. pmid: 18648509
- 15. Грайс Э.А., Сниткин Э.С., Йоки Л.Дж., Бермудез Д.М., Лихти К.В., Сегре Я.А. и др. Продольный сдвиг микробиоты диабетической раны коррелирует с длительной защитной реакцией кожи. Труды Национальной академии наук. 2010. 107 (33): 14799–804.
- 16.Nematian J, Ravaghi M, Gholamrezanezhad A, Nematian E. Повышенное выпадение волос может быть связано с присутствием Pityrosporum ovale. Американский журнал клинической дерматологии. 2006. 7 (4): 263–6. pmid: 167
- 17. Гупта А.К., Батра Р., Блум Р., Бекхаут Т., Доусон Т.Л. Кожные заболевания, связанные с видами Malassezia. Журнал Американской академии дерматологии. 2004. 51 (5): 785–98. pmid: 15523360
- 18. Glatz M, Bosshard PP, Hoetzenecker W, Schmid-Grendelmeier P.Роль Malassezia spp. при атопическом дерматите. Журнал клинической медицины. 2015; 4 (6): 1217–28. pmid: 26239555
- 19. Лейден Дж. Дж., Макгинли К. Дж., Миллс, Огайо, Клигман А. М.. Уровни пропионибактерий у пациентов с вульгарными угрями и без них. Журнал следственной дерматологии. 1975. 65 (4): 382–4. pmid: 126263
- 20. Ван Э, Ли JS-S, Хи TH. Связаны ли Propionibacterium acnes с волосками и облысением? Международный журнал трихологии. 2012; 4 (2): 93.pmid: 23180917
- 21. Chew E, Ho BY, Ramasamy S, Dawson T., Tennakoon C, Liu X и др. Сравнительное профилирование транскриптомов позволяет по-новому взглянуть на механизмы прогрессирования андрогенетической алопеции. Британский журнал дерматологии. 2016.
- 22. О Дж, Берд А.Л., Деминг С., Конлан С., Программа NCS, Kong HH и др. Биогеография и функция формы индивидуальности в метагеноме кожи человека. Природа. 2014. 514 (7520): 59–64. pmid: 25279917
- 23. Chronnell CM, Ghali LR, Quinn AG, Bull JJ, McKay IA, Philpott MP, et al.Экспрессия человеческого β-дефенсина-1 и-2 в волосяных единицах человека: активация при поражениях обыкновенных угрей. Журнал следственной дерматологии. 2001. 117 (5): 1120–5. pmid: 11710922
- 24. Ким Дж., Очоа М.-Т, Круцик С.Р., Такеучи О, Уэмацу С., Легаспи А.Дж. и др. Активация толл-подобного рецептора 2 при акне вызывает воспалительные цитокиновые реакции. Журнал иммунологии. 2002. 169 (3): 1535–41. pmid: 12133981
- 25. Chew EG, Ho BS, Ramasamy S, Dawson T., Tennakoon C, Liu X и др.Сравнительное профилирование транскриптомов позволяет по-новому взглянуть на механизмы прогрессирования андрогенетической алопеции. Британский дерматологический журнал. 2017; 176 (1): 265–9. pmid: 27239811
- 26. Хо Б.С., Ваз С., Рамасами С., Чу Э. Г., Мохаммед Дж. С., Танавде В. и др. Прогрессивная экспрессия гена гамма-коактиватора рецептора, активируемого пролифератором пероксисом (PPARGC1α), вызывает миниатюризацию волос при андрогенной алопеции Proc Natl Acad Sci U S. A. (рукопись представлена). 2017.
- 27.Лай Ю., Коген А.Л., Радек К.А., Парк Х.Дж., МакЛауд Д.Т., Лейхтл А. и др. Активация TLR2 небольшой молекулой, продуцируемой Staphylococcus epidermidis, повышает противомикробную защиту от бактериальных кожных инфекций. Журнал следственной дерматологии. 2010. 130 (9): 2211–21. pmid: 20463690
- 28. Nakatsuji T, Kao MC, Zhang L, Zouboulis CC, Gallo RL, Huang C-M. Жирные кислоты, не содержащие кожного сала, усиливают врожденную иммунную защиту себоцитов человека за счет усиления экспрессии β-дефенсина-2.Журнал следственной дерматологии. 2010. 130 (4): 985–94. pmid: 20032992
- 29. Онг П.Ю., Люн Д.Ю. Бактериальные и вирусные инфекции при атопическом дерматите: всесторонний обзор. Клинические обзоры по аллергии и иммунологии. 2016; 51 (3): 329–37.
- 30. Матард Б., Мейлхеук Т., Бриандет Р., Казин I, Ассули П., Кавелье-Баллой Б. и др. Первые доказательства бактериальных биопленок в анаэробной части волосяных фолликулов кожи головы: пилотное сравнительное исследование декальвантов фолликулита.Журнал Европейской академии дерматологии и венерологии. 2013. 27 (7): 853–60. pmid: 22779760
- 31. Костелло Е.К., Лаубер К.Л., Хамади М., Фирер Н., Гордон Дж. И., Найт Р. Изменчивость бактериального сообщества в средах обитания человеческого тела в пространстве и времени. Наука. 2009. 326 (5960): 1694–7. pmid: 19892944
- 32. Kong HH, Андерссон Б., Клавель Т., Common JE, Джексон С.А., Олсон Н.Д. и др. Исследование микробиома кожи: метод безумия. Журнал следственной дерматологии.2017; 137 (3): 561–8. pmid: 28063650
- 33. Мейзел Дж. С., Ханниган Г. Д., Тайлдсли А. С., Сан-Мигель А. Дж., Ходкинсон Б. П., Чжэн К. и др. Исследования микробиома кожи сильно зависят от дизайна экспериментов. Журнал следственной дерматологии. 2016; 136 (5): 947–56. pmid: 26829039
- 34. Кастелино М., Эйр С., Моут Дж., Фокс Дж., Мартин П., Хо П и др. Оптимизация методов исследования микробиома кожи: выбор праймера и сравнение платформы 454 с платформой MiSeq.BMC микробиология. 2017; 17 (1): 23. pmid: 28109256
- 35. Росс А.А., Мюллер К.М., Виз Дж. С., Нойфельд Дж. Д.. Комплексный анализ микробиома кожи выявляет уникальность кожи человека и свидетельствует о филосимбиозе в классе Mammalia. Труды Национальной академии наук. 2018.
- 36. Онг Ш., Куккиллая В.Ю., Вильм А., Лей С, Ho EXP, Low L и др. Идентификация видов и профилирование сложных микробных сообществ с использованием дробовика Illumina секвенирования последовательностей ампликона 16S рРНК.PLoS One. 2013; 8 (4): e60811. pmid: 23579286
- 37. Солтер С.Дж., Кокс М.Дж., Турек Е.М., Калус С.Т., Куксон В.О., Моффатт М.Ф. и др. Загрязнение реагентов и лабораторий может критически повлиять на анализ микробиома, основанный на последовательностях. Биология BMC. 2014; 12 (1): 87.
- 38. Martina P, Bettiol M, Vescina C, Montanaro P, Mannino MC, Prieto CI и др. Генетическое разнообразие изолятов Burkholderia contaminans от пациентов с муковисцидозом в Аргентине. Журнал клинической микробиологии.2013. 51 (1): 339–44. pmid: 23135937
- 39. Гован Дж. Р., Деретич В. Микробный патогенез при муковисцидозе: слизистая синегнойная палочка и Burkholderia cepacia. Микробиологические обзоры. 1996. 60 (3): 539–74. pmid: 8840786
- 40. Grice EA, Kong HH, Renaud G, Young AC, Bouffard GG, Blakesley RW и др. Профиль разнообразия микробиоты кожи человека. Исследование генома. 2008. 18 (7): 1043–50. pmid: 18502944
- 41. О Дж, Берд А.Л., Парк М., Конг Х.Х., Сегре Дж.А., Программа NCS.Временная стабильность микробиома кожи человека. Клетка. 2016; 165 (4): 854–66. pmid: 27153496
- 42. Финдли К., О Дж., Ян Дж., Конлан С., Деминг С., Мейер Дж. А. и др. Топографическое разнообразие грибковых и бактериальных сообществ на коже человека. Природа. 2013. 498 (7454): 367–70. pmid: 23698366
- 43. Хан СС, Пак Й.Т., Ю Дж.Х., Пак ТХ, Ким КДЖ. Сравнительная оценка плотности волос и сгруппированного рисунка волосков при андрогенной алопеции и нормальной волосистой части головы. Анналы дерматологии.2004. 16 (1): 1–8.
- 44. Инуи С., Накадзима Т., Итами С. Дермоскопия кожи головы андрогенной алопеции у азиатских людей. Журнал дерматологии. 2009. 36 (2): 82–5. pmid: 19284450
- 45. Trüeb RM. Молекулярные механизмы андрогенетической алопеции. Экспериментальная геронтология. 2002. 37 (8): 981–90.
- 46. Young JW, Conte E, Leavitt M, Nafz M, Schroeter A. Кожная иммунопатология андрогенетической алопеции. Журнал Американской остеопатической ассоциации.1991. 91 (8): 765–71. pmid: 1744007
- 47. Перри А., Ламберт П. Propionibacterium acnes: инфекция за пределами кожи. Экспертный обзор противоинфекционной терапии. 2011; 9 (12): 1149–56. pmid: 22114965
- 48. Bojar RA, Голландия KT. Угри и Propionibacterium acnes. Клиники дерматологии. 2004. 22 (5): 375–9. pmid: 15556721
- 49. Tanaka A, Cho O, Saito C, Saito M, Tsuboi R, Sugita T. Комплексный пиросеквенирующий анализ бактериальной микробиоты кожи пациентов с себорейным дерматитом.Микробиология и иммунология. 2016; 60 (8): 521–6. pmid: 27301664
- 50. Холланд К., Гринман Дж., Канлифф В. Рост кожных пропионибактерий на синтетической среде; урожайность роста и производство экзоферментов. Журнал прикладной микробиологии. 1979; 47 (3): 383–94.
- 51. Кирали С.Л., Ален М., Корвола Дж., Хорсманхеймо М. Влияние тестостерона и анаболических стероидов на липиды поверхности кожи и популяцию Propionibacteria acnes у молодых мужчин постпубертатного возраста.Acta dermato-venereologica. 1988. 68 (1): 21–6. pmid: 2449007
- 52. Saint-Leger D, Bague A, Lefebvre E, Cohen E, Chivot M. Возможная роль сквалена в патогенезе акне. II. Исследование in vivo оксидов сквалена на поверхности кожи и внутрикомедональных липидов пациентов с угревой сыпью. Британский дерматологический журнал. 1986. 114 (5): 543–52. pmid: 2941050
- 53. Оттавиани М., Алестас Т., Флори Э., Мастрофранческо А., Зубулис С.С., Пикардо М. Перекисный сквален вызывает выработку медиаторов воспаления в кератиноцитах HaCaT: возможная роль в вульгарных угрях.J Invest Dermatol. 2006. 126 (11): 2430–7. pmid: 16778793
- 54. Макдауэлл А., Барнард Э., Надь И., Гао А., Томида С., Ли Х и др. Расширенная схема мультилокусного типирования последовательностей для Propionibacterium acnes: исследование «патогенных», «комменсальных» и устойчивых к антибиотикам штаммов. ПлоС один. 2012; 7 (7): e41480. pmid: 22859988
- 55. Фитц-Гиббон С., Томида С., Чиу Б.Х., Нгуен Л., Ду Си, Лю М. и др. Популяции штаммов Propionibacterium acnes в микробиоме кожи человека, связанные с акне.J Invest Dermatol. 2013. 133 (9): 2152–60. pmid: 23337890
- 56. Квак М.Х., Ан Дж.С., Ким М.К., Ким Дж.С., Сун Ю.К. Индуцируемый дигидротестостероном IL-6 ингибирует удлинение стержней человеческих волос путем подавления пролиферации матричных клеток и способствует регрессии волосяных фолликулов у мышей. J Invest Dermatol. 2012; 132 (1): 43–9. pmid: 21881585
- 57. Гарза Л.А., Лю Й., Ян З., Алагесан Б., Лоусон Дж. А., Норберг С. М. и др. Простагландин D2 подавляет рост волос и его уровень повышен на лысой коже головы мужчин с андрогенной алопецией.Трансляционная медицина науки. 2012; 4 (126): 126ra34.
- 58. Hruza LL, Pentland AP. Механизмы воспаления, вызванного УФ-излучением. Журнал следственной дерматологии. 1993; 100 (1): S35 – S41.
- 59. Schirmer M, Smeekens SP, Vlamakis H, Jaeger M, Oosting M, Franzosa EA, et al. Связь микробиома кишечника человека с производительностью воспалительных цитокинов. Клетка. 2016. 167 (4): 1125–36. e8. pmid: 27814509
- 60. Наик С., Буладу Н., Вильгельм С., Моллой М.Дж., Сальседо Р., Кастенмюллер В. и др.Компартментальный контроль кожного иммунитета резидентными комменсалами. Наука. 2012. 337 (6098): 1115–9. pmid: 22837383
- 61. Pierard-Franchimont C, De Doncker P, Cauwenbergh G, Pierard G. Шампунь с кетоконазолом: эффект длительного использования при андрогенной алопеции. Дерматология (Базель, Швейцария). 1998. 196 (4): 474–7.
- 62. Piérard G, Pierard-Franchimont C, Nikkels-Tassoudji N, Nikkels A, Léger DS. Улучшение воспалительного аспекта андрогенной алопеции.Пилотное исследование противомикробного лосьона. Журнал дерматологического лечения. 1996. 7 (3): 153–7.
- 63. Ho EXP, Cheung CMG, Sim S, Chu CW, Wilm A, Lin CB и др. Микробиота глотки человека при возрастной дегенерации желтого пятна. ПлоС один. 2018; 13 (8): e0201768. pmid: 30089174
- 64. Миллер К.С., Бейкер Б.Дж., Томас Б.К., Певец С.В., Банфилд Дж. Ф. EMIRGE: реконструкция полноразмерных рибосомных генов на основе данных короткого чтения микробного сообщества. Геномная биология.2011; 12 (5): R44. pmid: 21595876
- 65. ДеСантис Т.З., Хугенгольц П., Ларсен Н., Рохас М., Броди Е.Л., Келлер К. и др. Greengenes, проверенная химерами база данных генов 16S рРНК и рабочая среда, совместимая с ARB. Прикладная и экологическая микробиология. 2006. 72 (7): 5069–72. pmid: 16820507
Спросите экспертов: Тестирование волос по сравнению с тестированием волосяного фолликула
Вопрос: В чем разница между тестированием волос на наркотики и тестированием волосяных фолликулов?
Называть тест волос тестом волосяного фолликула – распространенное неправильное употребление.Мы обратились к доктору Барри Сэмплу, старшему директору по науке и технологиям, Quest Diagnostics, научному эксперту в нашей лаборатории тестирования волос на наркотики в Ленексе, штат Канзас, чтобы лучше понять терминологию тестирования волос и процесс сбора тестов для волос.
Что такое волосяной фолликул?
Волосяной фолликул – это фактически карман под кожей головы, из которого растет прядь волос. Настоящий тест на «волосяной фолликул» может быть довольно болезненным для донора, поскольку он, скорее всего, будет включать выщипывание волос с кожи головы.Следовательно, во время сбора волос волосы обрезаются как можно ближе к коже головы, поэтому проверяются только пряди волос над кожей головы, а не сам волосяной фолликул.
Во время отбора проб волос сборщик отрезает примерно 100–120 прядей волос на макушке головы донора. Когда образец берется с коронки, достаточное количество волос доступно для тестирования, не вызывая косметического воздействия на донора.
Собранные пряди волос выравниваются и помещаются в пакет из фольги, поставляемый с каждым набором для сбора волос.Коллектор выравнивает корневые концы волос со скошенным концом фольги, а затем складывает фольгу пополам, чтобы закрепить волосы. Затем фольга и волосы вставляются в конверт с образцом для испытания волос. После получения образца волос лаборатория измеряет и отрезает 3,9 сантиметра волос от области, ближайшей к корню, и проверяет образец волос на предмет злоупотребления наркотиками.
Почему следует выбирать тестирование волос
Тестирование волос – единственный доступный метод тестирования на наркотики, который обеспечивает период обнаружения до 90 дней, что является эффективным способом оценки долгосрочных моделей повторяющегося употребления.
