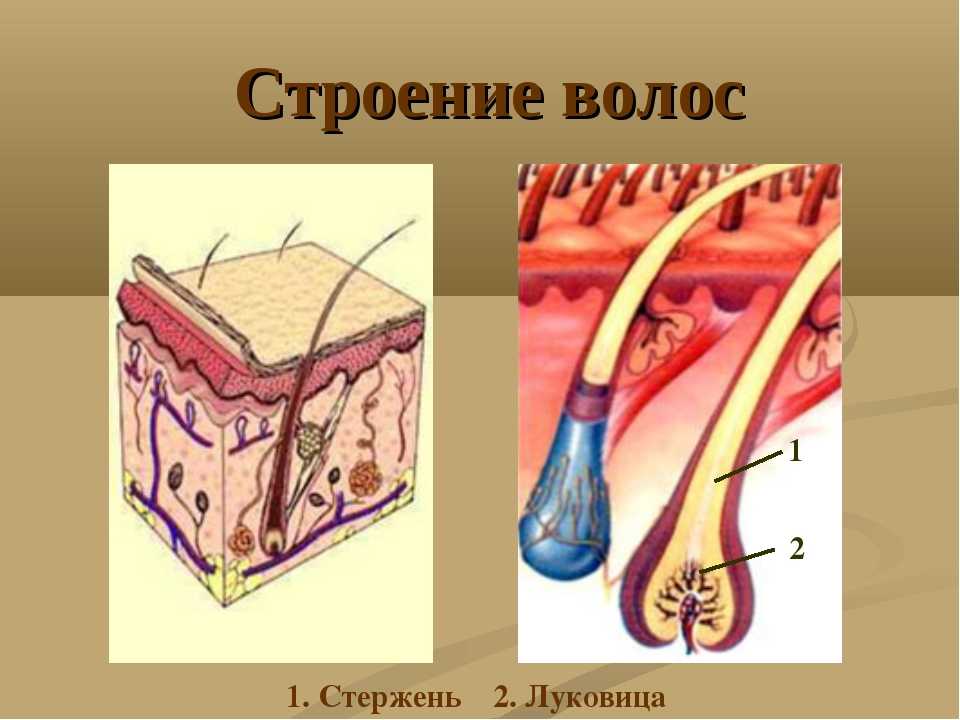
- Три слоя
- Оценка количества слабосвязанных белков стержня волоса при алопеции
- Волосы: фолликулы, связанные структуры и рост
- Захват и профилирование стволовых клеток волосяных фолликулов взрослых Существование базальных клеток лимбального эпителия с медленным циклом, которые можно предпочтительно стимулировать к пролиферации: последствия для эпителиальных стволовых клеток.
Три слоя
3 загадочных слоя и луковица
Волосы – это роговые образования кожи, покрывающие почти всю поверхность тела.
Свойства волос зависят от их состояния. Здоровые обычно прочны и упруги. Волос можно растянуть на 1/5 его длины, и после этого он возвращается к своему состоянию. По прочности волосы сравнимы с алюминием и способны выдержать нагрузку от 100 до 200 кг. Неудивительно, что в старину из женских кос сплетали веревки, предназначенные для подъема больших грузов.
Волосы гигроскопичны, то есть они способны впитывать влагу. Они довольно устойчивы к воздействию некрепких кислот, но плохо переносят щелочные составы. Именно на эти свойства ориентируются производители очищающих средств.
Волос – живой?
С точки зрения физиологии, стержень волоса который мы видим, – субстанция, которую нельзя по праву назвать живой. Он не снабжается кровью, к нему не подходят нервные волокна и не крепятся мышцы.
Волосяной фолликул – (в очень упрощенном виде) место где размножаются живые клетки и образуют корень волоса (луковица).
Мы рождаемся на свет с определенным количеством таких фолликулов, величина эта генетически запрограммированна.
В основании фолликула и дерме находятся волосяной сосочек – соединительное образование, содержащее сосуды кожи. Волосяной сосочек обеспечивает питание и ростовую активность волосяного фолликула в котором активно размножаются живые клетки.
Каждый волосяной фолликул является независимым образованием со своим собственным ростовым циклом. В разных фолликулах циклы эти не синхронны, иначе у нас выпадали бы волосы все одновременно.
Так же, каждый волосяной фолликул при хорошем состоянии организма способен произвести 25 – 27 новых волос, а это очень много, учитывая цикл смены волос каждые 5 – 7 лет.
3 слоя
Медула (стержень) – это центральная часть волосяного стержня, которая представлена у человека не во всех видах волос. Медула не играет никакой роли в изменениях как химических, так и физических свойств волоса. В действительности, медула почти не изученная область волоса.
Кортекс (корковый слой) – основное вещество волоса (составляет 80-85% от объем волоса) которое состоит из миллиона кератиновых волокон. Они закручены между собой и связаны прочными поперечными связями. Эти клетки содержат пигмент – красящее вещество. Пигмент может быть рыжим, желтым или черным, а сочетание этих цветов создает индивидуальный цвет волос.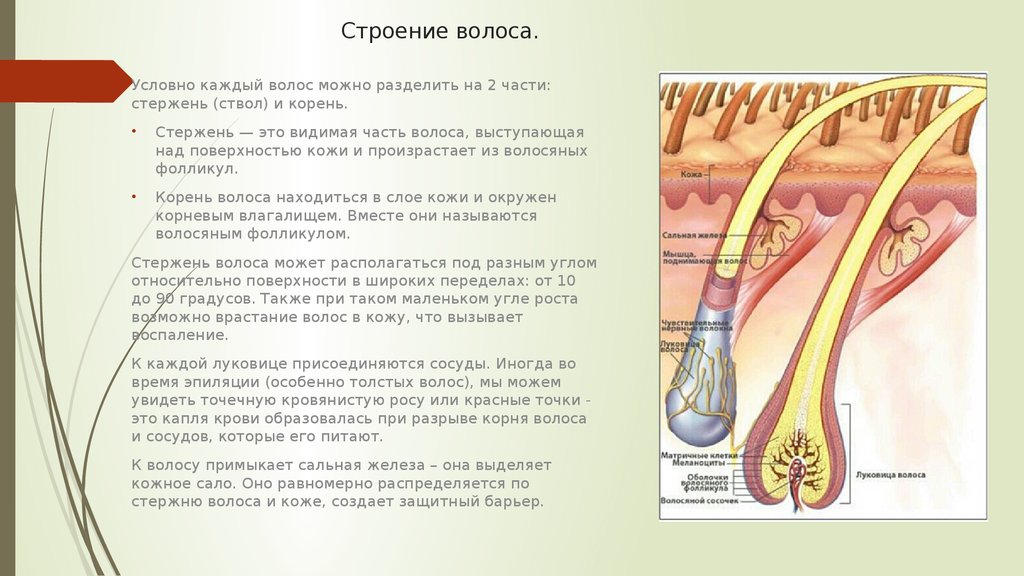
Кутикула – наружный слой, выполняет защитную, барьерную функцию. Она образована 6-10 перекрывающимися слоями прозрачных пластинок кератина, связанных между собой как многочисленными поперечными связями, так и липидными прослойками. Кутикула препятствует механическим и физическим воздействиям на волос. Неповрежденная кутикула хорошо отражает свет: волосы блестят, эластичны и не ломаются.
Оценка количества слабосвязанных белков стержня волоса при алопеции
Изменение функциональной активности волосяных фолликулов и нарушение цикла их развития может привести к выпадению волос (алопеции). Однако вопрос о существовании прямой связи между функциональной активностью волосяных фолликулов и качеством формируемого ими волоса практически не изучен.
Стержень волоса на 80% состоит из белков (кератинов). Высокомолекулярные кератины (так называемые тяжелые, молекулярная масса которых превышает 20 кД) обладают низкой растворимостью и образуют фибриллы, находящиеся в слое кортекса.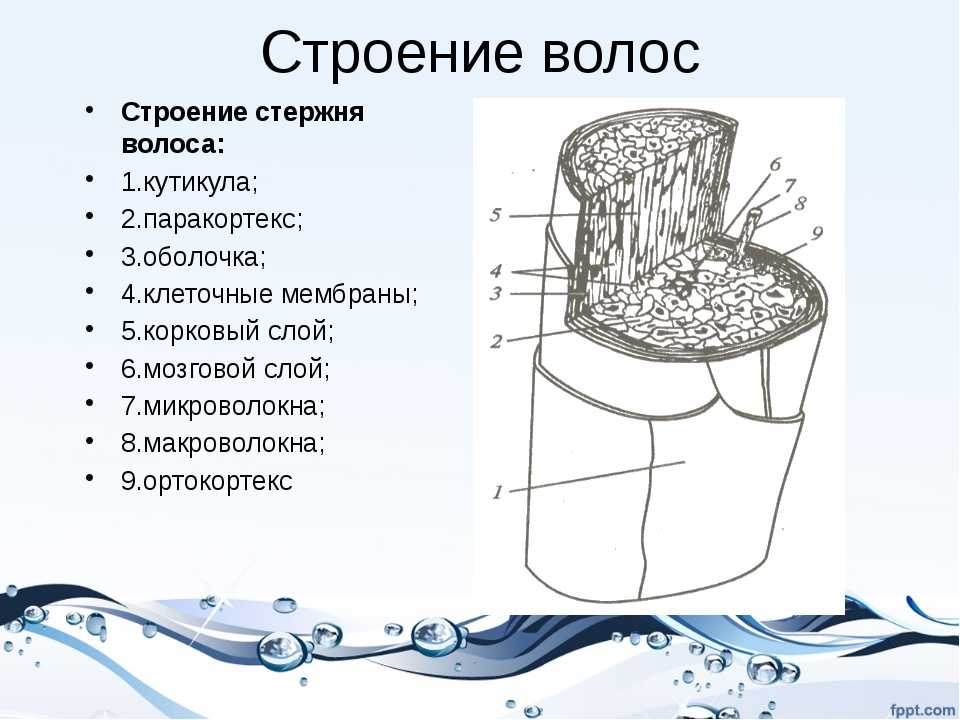 Они окружены матриксом, состоящим из легких низкомолекулярных кератинов с молекулярной массой 6—20 кД. Легкие кератины растворимы в воде и при повреждении кутикулы волоса или при ослаблении связей с другими белками кортекса могут вымываться из стержня волоса. Показано, что вымывание белков усиливается при повреждении кутикулы в результате отбеливания и химической завивки [1, 2]. В свою очередь повреждение кутикулы может открывать внешним воздействиям более глубокие слои стержня волоса, что ведет к дальнейшему ослаблению связей между белками кортекса [3].
Они окружены матриксом, состоящим из легких низкомолекулярных кератинов с молекулярной массой 6—20 кД. Легкие кератины растворимы в воде и при повреждении кутикулы волоса или при ослаблении связей с другими белками кортекса могут вымываться из стержня волоса. Показано, что вымывание белков усиливается при повреждении кутикулы в результате отбеливания и химической завивки [1, 2]. В свою очередь повреждение кутикулы может открывать внешним воздействиям более глубокие слои стержня волоса, что ведет к дальнейшему ослаблению связей между белками кортекса [3].
Это означает, что усиление процесса вымывания белков из волоса может отражать не только внешние повреждения, затрагивающие кутикулу, но и изменение структуры кортекса, прежде всего увеличение содержания слабосвязанных белков [1]. Такие слабосвязанные белки постепенно вымываются из стержня волоса, а при механической гомогенизации волоса в водной среде переходят в раствор (растворимые белки).
Остается неизвестным, зависит ли увеличение содержания слабосвязанных белков только от внешних воздействий или может быть следствием нарушения функциональной активности волосяных фолликулов при алопеции.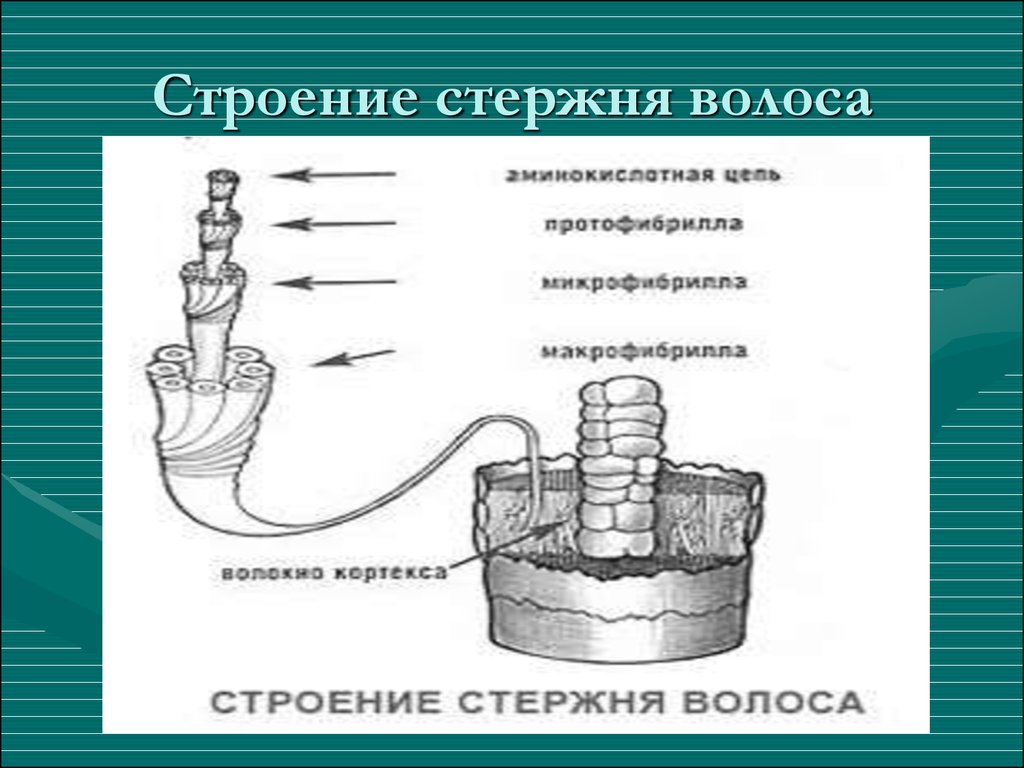
Цель работы — оценка количества слабосвязанных белков волос пациентов с андрогензависимой алопецией (АГА) и телогеновым выпадением (ТВ) волос. В работе оценивали скорость вымывания белков из стержня волоса в стандартных условиях. Результаты сопоставляли с данными для здоровых добровольцев. Затем волосы подвергали механической дезинтеграции в водной среде и оценивали содержание растворимых белков. Материал для исследований (волосы) брали с теменной и затылочной зоны волосистой части головы.
Материал и методы
Измерение поглощения света проводили на спектрофотометре Shimadzu UV-1700, флюоресценцию проб измеряли на спектрофлюориметре Hitachi F 4000.
Использовали следующие реактивы: бычий сывороточный альбумин (БСА; «Sigma»), кератин из эпидермиса человека («Sigma»), L-триптофан («Calbiochem»), карбонатный буферный раствор 0,1 М, рН 10,2.
Объектом исследований служили волосы пациентов с АГА (20 человек, из них 2 мужчины; возраст 35±10 лет) и ТВ (46 человек, из них 3 мужчины; возраст 33±9 лет), а также здоровых добровольцев (ЗД) — лиц без трихологической патологии (30 человек, из них 5 мужчин; возраст 26±12 лет).
Волосы извлекали с помощью пинцета из зоны темени и затылка. Материал помещали в отдельные герметичные пластиковые пакеты и хранили при 8 °С.
Получение проб вымываемого белка
Вымывание белка проводили следующим образом: фрагменты волос длиной около 10 мм взвешивали и помещали в карбонатный буферный раствор (0,1 М, рН 10,2) так, чтобы соотношение массы волос и буферного раствора составляло 1:250. Инкубировали пробы при комнатной температуре в течение 30 мин при постоянном мягком встряхивании. Отбирали жидкость и осаждали механические примеси центрифугированием при 900 об/мин в течение 15 мин. Полученные пробы вымываемого белка использовали для измерений.
Анализ динамики вымывания белков (рис. 1)Рисунок 1. Вымывание белка при инкубации волос ЗД в буферном растворе (рН 10,2) в зависимости от времени инкубации. Результаты представлены в пересчете на вес образца волос мг/г. Оценку белка проводили путем измерения поглощения проб при 240 нм.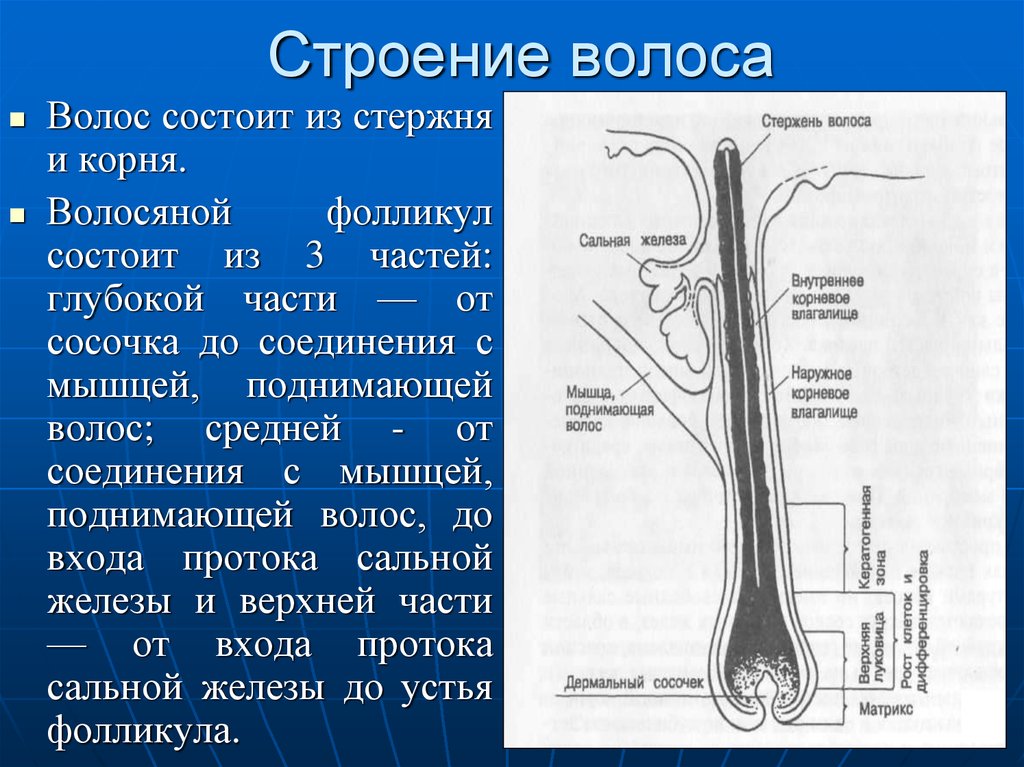
Получение проб растворимого белка
После получения вымываемого белка волосы помещали в ручной гомогенизатор Поттера и растирали до получения однородной суспензии в буферном растворе. Нерастворимую фракцию осаждали центрифугированием (900 об/мин, 30 мин). Отбирали прозрачный супернатант, содержащий растворимые белки.
Оценка содержания белка
Для оценки белка волос были опробованы три метода: биуретовый, Лоури и поглощение света в ультрафиолетовой части спектра.
Результаты пересчитывали на белковый эквивалент, используя в качестве стандарта БСА, и нормировали на вес пробы волос (мг белка/г волос).
Оценку белков в реакции с биуретовым реактивом проводили с использованием набора реактивов RANDOX (Великобритания), для метода Лоури применяли реактивы компании «Sigma». Биуретовый метод был принят в качестве референтного, поскольку его результаты почти не зависят от специфики исследуемого белка. Этот метод с успехом применялся при работе с большим количеством материала (20 мг в 1 мл буферной среды) [2].
Биуретовый метод был принят в качестве референтного, поскольку его результаты почти не зависят от специфики исследуемого белка. Этот метод с успехом применялся при работе с большим количеством материала (20 мг в 1 мл буферной среды) [2].
Метод Лоури [4] также применялся для исследования вымываемых белков [3], однако и в этом случае вносили 10—15 мг волос в 1 мл водной среды.
В нашей работе при использовании метода Лоури получены значительно заниженные результаты по сравнению с биуретовым методом. Причина, по-видимому, заключается в том, что фенольный реактив Фолина реагирует с ароматическими аминокислотами белка, особенно с тирозином, а, по нашим данным, в экстрактах волос молярная доля тирозина мала.
Предложенный нами третий метод — поглощение света в области 240 нм — оказался чувствительнее к белку волос, чем биуретовый метод, и позволил проводить измерения в диапазоне 1—2 мг волос в 1 мл. Полученные нами спектры поглощения вымываемого белка (рис.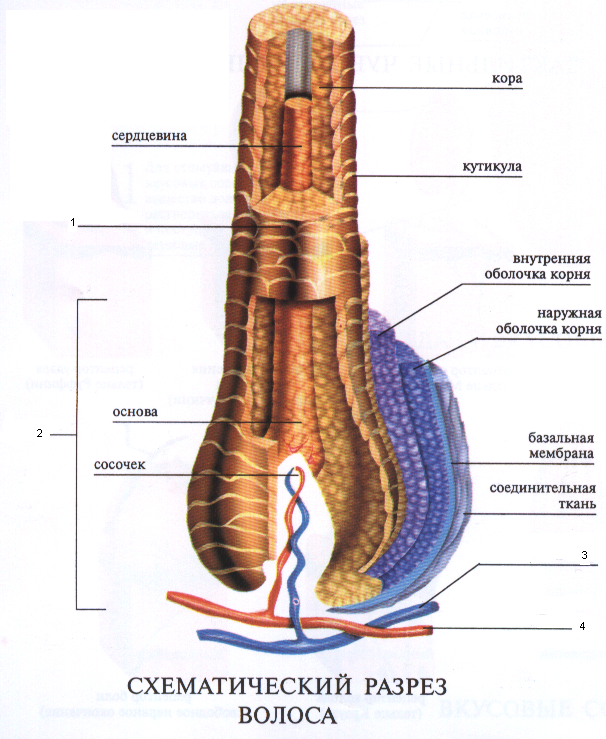 2),Рисунок 2. Спектры поглощения кератина (1), БСА (2), вымываемого белка волос ЗД (3). Концентрация кератина и БСА — 20 мкг/мл. Вымываемый белок получен при инкубации 5 мг волос донора в 1 мл карбонатного буферного раствора (30 мин при комнатной температуре) и разведен водой из расчета 1:5. Значения оптической плотности представлены за вычетом показателей для соответствующего разведения карбонатного буферного раствора. а также кератина и альбумина в диапазоне 220—300 нм обнаружили максимум поглощения всех исследованных образцов при длине волны 230 нм.
2),Рисунок 2. Спектры поглощения кератина (1), БСА (2), вымываемого белка волос ЗД (3). Концентрация кератина и БСА — 20 мкг/мл. Вымываемый белок получен при инкубации 5 мг волос донора в 1 мл карбонатного буферного раствора (30 мин при комнатной температуре) и разведен водой из расчета 1:5. Значения оптической плотности представлены за вычетом показателей для соответствующего разведения карбонатного буферного раствора. а также кератина и альбумина в диапазоне 220—300 нм обнаружили максимум поглощения всех исследованных образцов при длине волны 230 нм.
Для того чтобы избежать резких колебаний за счет случайных смещений пика поглощения, в дальнейшем измеряли поглощение при длине волны 240 нм.
При измерении растворимого белка волос ЗД биуретовым методом концентрация белка составила 9 мг/г волоса, метод Лоури — 0,9 мг/г, а по поглощению света — 10 мг/г, т.е. практически как при применении биуретового реактива.
Несмотря на обнаруженные расхождения между методом оценки белка по поглощению при длине волны 240 нм и методом Лоури, мы выявили линейную зависимость между данными обоих методов при анализе растворимого белка волос ЗД (рис.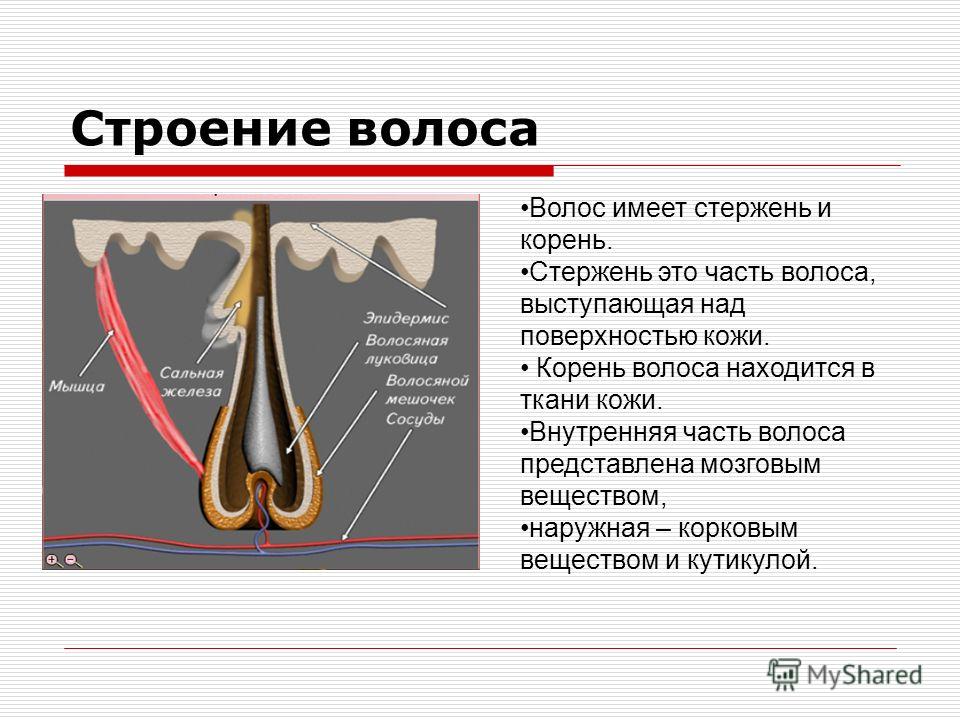 3).Рисунок 3. Связь между количеством растворимого белка волос ЗД (n=4) по данным измерения поглощения при 240 нм и методом Лоури. Коэффициент корреляции r=0,9, вероятность отсутствия корреляции р<0,01. Этот результат подтверждает наше предположение о том, что природа расхождения результатов заключается в специфичности метода Лоури.
3).Рисунок 3. Связь между количеством растворимого белка волос ЗД (n=4) по данным измерения поглощения при 240 нм и методом Лоури. Коэффициент корреляции r=0,9, вероятность отсутствия корреляции р<0,01. Этот результат подтверждает наше предположение о том, что природа расхождения результатов заключается в специфичности метода Лоури.
Оценка собственной флюоресценции слабосвязанных белков
Для оценки флюоресценции вымываемого белка пробу помещали в кювету с сечением 1×1 см и регистрировали спектр флюоресценции при длине волны возбуждения 290 нм.
Флюоресценция — чувствительный метод анализа белков, широко используемый при изучении внешних воздействий, прежде всего — ультрафиолетового излучения [5].
Результаты анализа спектров собственной флюоресценции вымываемых белков волоса и сопоставление их со спектрами кератина и триптофана (рис. 4)Рисунок 4. Спектры флюоресценции растворов кератина 0,05 мг/мл (1), триптофана 0,20 мг/мл (2) и типичные спектры флюоресценции вымываемых белков волос (тонкие точечные линии — 3, 4, 5, 6). Длина волны возбуждения 290 нм. подтверждают данные других исследователей о содержании в белках волоса не только триптофана, но и его производных (например, N-формилкинуренина [6]). Таким образом, метод позволяет регистрировать появление продуктов модификации триптофана для оценки свойств вымываемых и растворимых белков волос, но наличие нескольких пиков затрудняет их прямую количественную оценку.
Длина волны возбуждения 290 нм. подтверждают данные других исследователей о содержании в белках волоса не только триптофана, но и его производных (например, N-формилкинуренина [6]). Таким образом, метод позволяет регистрировать появление продуктов модификации триптофана для оценки свойств вымываемых и растворимых белков волос, но наличие нескольких пиков затрудняет их прямую количественную оценку.
Для оценки количества слабосвязанных белков нами был использован метод оценки поглощения света при длине волны 240 нм. Данные для пациентов и ЗД получены этим методом.
Статистическая обработка результатов. Для обработки результатов использовали программу Statistica 6.0. Независимые выборки (межгрупповые сравнения) сравнивали по критерию Манна—Уитни, а для связанных переменных (сравнение между зонами скальпа) использовали критерий Уилкоксона. Достоверными считали различия при р<0,05.
Результаты и обсуждение
Задачей нашего исследования была оценка количества слабосвязанных белков, т.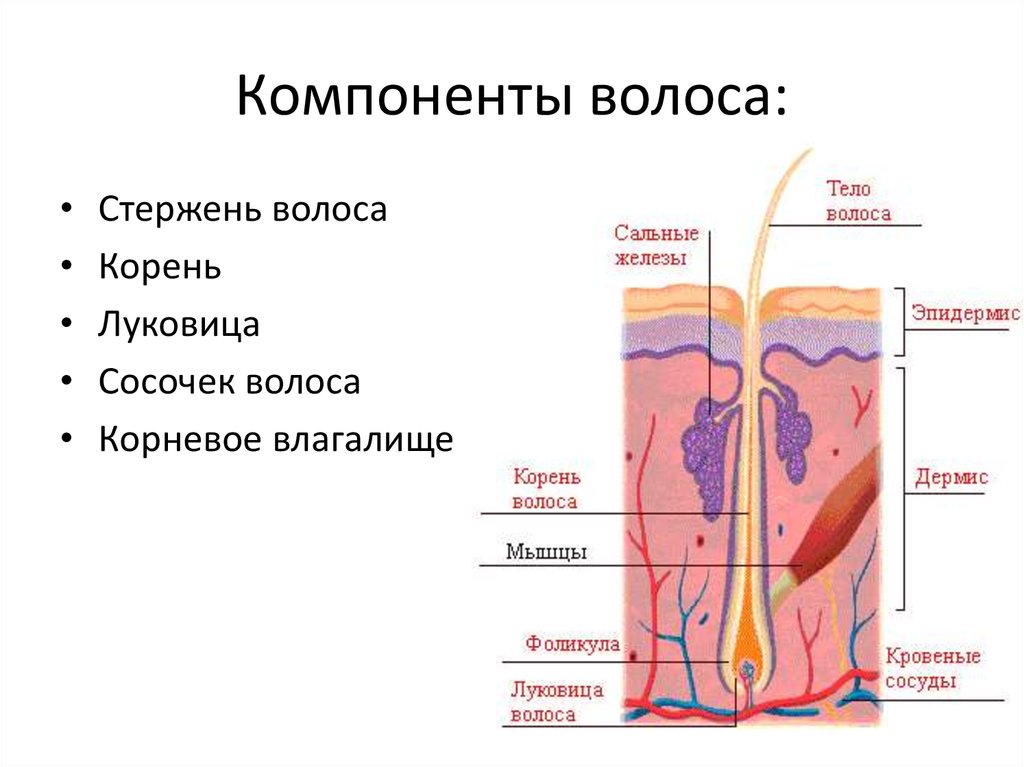 е. белков, вымываемых буферным раствором из стержня волоса за 30 мин (рис. 5, I)Рисунок 5. Схема анализа волос пациентов и здоровых добровольцев. и переходящих в буферный раствор при механической дезинтеграции волоса (рис. 5, II). Схема анализа представлена на рис. 5.
е. белков, вымываемых буферным раствором из стержня волоса за 30 мин (рис. 5, I)Рисунок 5. Схема анализа волос пациентов и здоровых добровольцев. и переходящих в буферный раствор при механической дезинтеграции волоса (рис. 5, II). Схема анализа представлена на рис. 5.
Такая схема анализа позволила сравнивать скорость вымывания белка между группами и зонами волосистой части головы в каждой группе (см. таблицу).
Обнаруженные различия можно было соотнести с количеством растворимого белка волоса, получаемого при его механическом разрушении.
Наибольшая скорость вымывания белка обнаружена у пациентов с АГА. В зоне темени значение данного показателя у этих пациентов достоверно отличалось от такового ЗД (p<0,01) и было больше, чем в зоне затылка у этих же пациентов (p<0,02).
Поскольку скорость вымывания белка может быть следствием изменения белкового профиля в кортексе волоса, согласно выбранной схеме анализа (см. рис. 4) измеряли количество растворимого белка после разрушения волоса.
рис. 4) измеряли количество растворимого белка после разрушения волоса.
Содержание растворимого белка в волосах, полученных с зоны темени, было выше, чем у ЗД (p<0,01) и в зоне затылка (p<0,05). Этот результат подтвердил закономерности, полученные при анализе скорости вымывания белка.
В целом увеличение скорости вымывания белка в зоне темени по сравнению с зоной затылка отмечалось у 70% с АГА, в 55% случаев значения показателя были выше верхней границы значений, полученных для ЗД. В зоне затылка обнаружилось увеличение количества слабосвязанных белков по сравнению с нормой, но оно выявлялось только после разрушения волос (растворимый белок, p<0,05).
У пациентов с ТВ скорость вымывания белка превышала таковую у ЗД здоровых добровольцев преимущественно в зоне затылка (p<0,01), однако количество растворимого белка не отличалось от показателей, полученных у ЗД. Более того, содержание растворимого белка в волосах из зоны темени у этих пациентов было достоверно выше, чем в зоне затылка (p<0,05).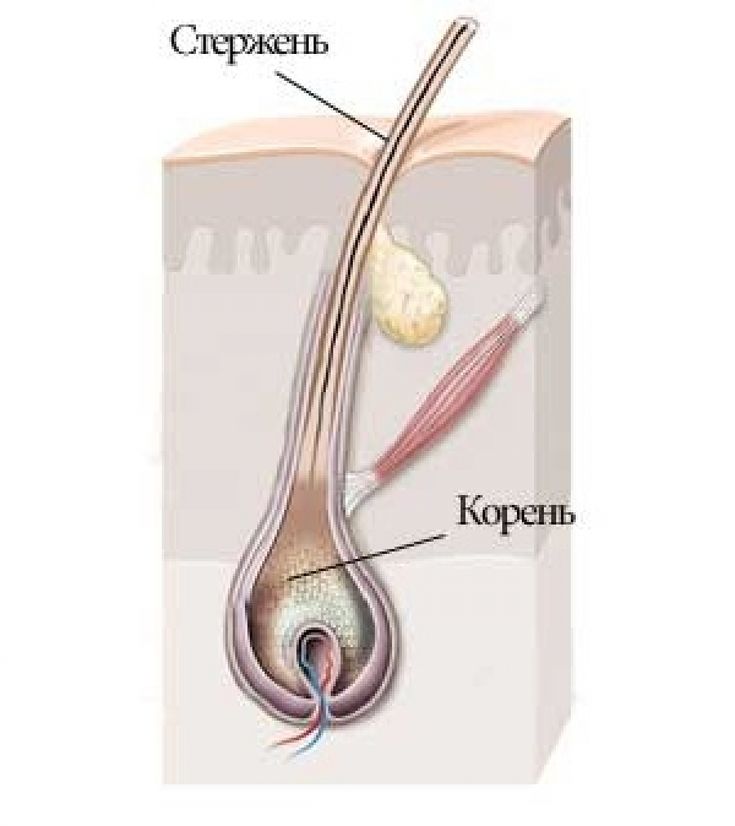
У ЗД достоверных различий между зонами ни при анализе скорости вымывания белка, ни при оценке растворимого белка не выявлено.
Механизмы выпадения волос при АГА и ТВ различаются. Общим является сокращение продолжительности цикла анагена у значительного количества волос с преждевременным наступлением стадии катагена и последующей стадии телогена. ТВ свойственно диффузное поредение, тогда как при андрогенетическом выпадении страдает андрогензависимая область скальпа — лоб, темя. Кроме того, причины ТВ могут быть разной природы (диета, стресс, реакция на лекарственные препараты), что обусловливает значительный разброс данных, поскольку перечисленные факторы по-разному влияют на содержание слабосвязанных белков в стержне волоса.
По-видимому, при АГА механизм, связывающий процессы регуляции жизни фолликула и синтеза белка, является общим для большинства пациентов, что позволило выявить достоверные различия по сравнению с ЗД, а также между зоной облысения (темя) и нормального роста (затылок) при анализе слабосвязанных белков.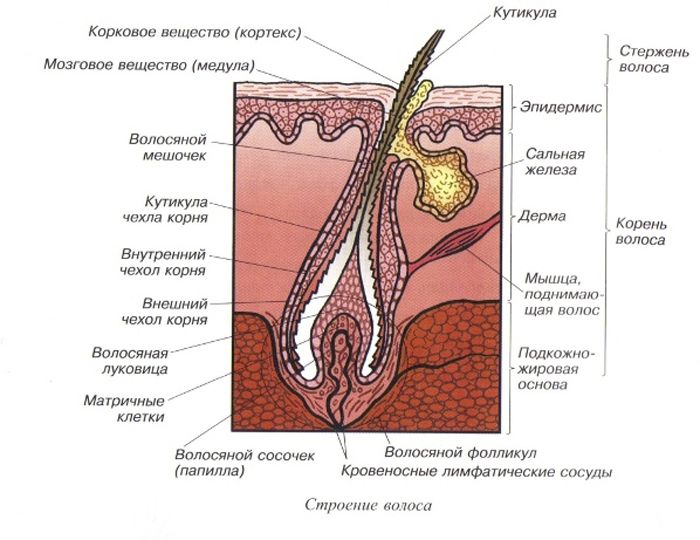
Полученные результаты позволяют сформулировать следующие положения.
В стержне волос имеются растворимые белки, слабо связанные между собой и механическим каркасом стержня.
Чувствительным и достаточно простым методом оценки количества растворимых (слабосвязанных) белков волос может служить анализ белка по поглощению света при длине волны 240 нм.
Среднее содержание слабосвязанных растворимых белков у ЗД оценено как 18±2 мг на 1 г волос. Различий в показателях для затылочной и теменной областями головы не отмечено.
У пациентов с АГА по сравнению со ЗД наблюдается значительно (примерно в 2 раза) повышенный выход слабосвязанных белков в волосах зоны темени. Это увеличение регистрируется как при измерении скорости вымывания белков из волоса, так и при оценке количества растворимых белков после дезинтеграции волоса.
У пациентов с АГА наблюдается достоверное увеличение содержания слабосвязанных белков в волосах зоны темени по сравнению с волосами зоны затылка. Это различие обнаруживается как при измерении скорости вымывания белков, так и при оценке количества растворимых белков после дезинтеграции волоса.
Это различие обнаруживается как при измерении скорости вымывания белков, так и при оценке количества растворимых белков после дезинтеграции волоса.
У пациентов с ТВ волос обнаружено увеличение скорости вымывания белков в зоне затылка по сравнению со ЗД. При этом повышения содержания растворимых белков, измеренного после разрушения волоса, не наблюдалось.
При сравнении показателей между пациентами с АГА и ТВ по зонам волосистой части головы показано, что содержание слабосвязанных белков у пациентов с АГА в зоне темени было достоверно выше, чем у пациентов с ТВ. Это справедливо и в отношении скорости вымывания белков, и в отношении общего количества растворимых белков.
Оценка слабосвязанных белков волоса (скорости вымывания белков и общего количества растворимых белков) может быть полезным инструментом при анализе состояния волос пациентов с алопецией и для мониторинга лечения. Полученные результаты указывают на целесообразность использования при алопеции средств, укрепляющих стержень волоса.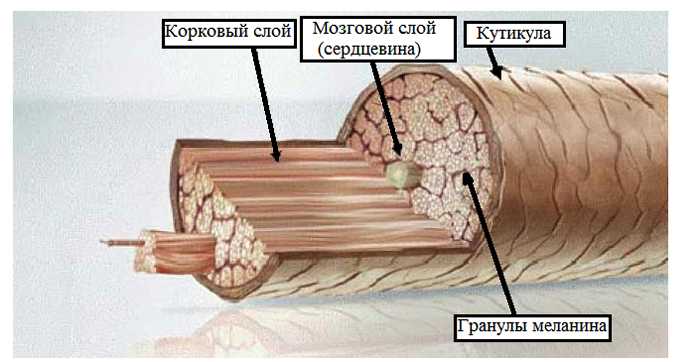
Волосы: фолликулы, связанные структуры и рост
Волосы человека часто рассматриваются как остатки гривы животного и продолжают играть как социальную роль (как символ молодости, здоровья и плодородия), так и биологическую роль (защищая макушку головы от солнца и за счет секвестрации и выделения нежелательных биохимических веществ). Волосы являются уникальной особенностью каждого человека и, в более общем смысле, человеческого вида. Подсчитано, что у взрослых людей около 5 миллионов волосяных фолликулов, из них 1 миллион волосяных фолликулов находится на голове, и только от 120 000 до 150 000 волосяных фолликулов покрывают кожу головы. В зависимости от участка кожи головы их плотность колеблется от 200 до 300 фолликулов/см2. Ежедневно естественным образом выпадает сто волосяных фолликулов. Скорость роста волос составляет около 0,3 мм в день или 12 см в год. На эту скорость влияют многочисленные факторы, такие как расположение фолликула, пол, возраст и этническая принадлежность человека, а также факторы окружающей среды.
Фолликул и связанные с ним структуры
Волосяные фолликулы представляют собой придатки кожи, возникающие в результате эпителиально-мезенхимальных взаимодействий, запрограммированных на третьем месяце эмбрионального развития. Эти миниатюрные органы способны к полной, автономной, циклической и асинхронной регенерации, уникальной для человеческого организма. Они регенерируют более 8-10 раз в течение жизни. Корень волосяного фолликула, расположенный на 4 мм ниже эпидермиса, включает сальные железы и взаимодействует с сопутствующими структурами (эпидермисом, дермой, мышцами, выпрямляющими волоски, сосудистой системой). Гистологический анализ сально-волосяной единицы показывает трехэлементную организацию: эпителиальный компартмент, мезенхимальный компартмент и сальная железа.
Эпителиальный компартментСостоит из матрикса, волосяного стержня, внутренней оболочки и наружной эпителиальной оболочки.
Матрица
Матрица , расположенная в основании фолликула и окружающая дермальный сосочек, содержит сильно пролиферативные и лишь слабо дифференцированные клетки.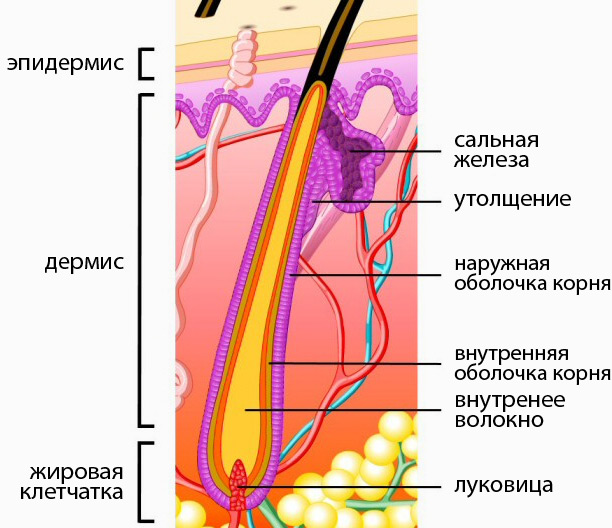 Эти клетки являются источником различных типов клеток, составляющих фолликул [анализы: FOLL-0003; ФОЛЛ-0004].
Эти клетки являются источником различных типов клеток, составляющих фолликул [анализы: FOLL-0003; ФОЛЛ-0004].
Стержень волоса
Это видимая структура волоса, состоящая из трех концентрических слоев (кутикулы, коры и сердцевины).
- Кутикула , внешний слой толщиной от 3,5 до 4,5 мкм, состоит из клеток, удерживаемых вместе цементом, богатым керамидами, который обеспечивает защиту базальных слоев.
- Кора , которая представляет собой средний слой и составляет 75% от общего диаметра, является основной частью волоса. Эта область в основном состоит из кератина, который отвечает за сплоченность, жесткость и эластичность волос. Он содержит пигменты меланина, которые придают цвет волосам [анализы: FOLL-0011; ФОЛЛ-0015]. Это производство зависит от экспрессии и регуляции ключевых генов [Анализ: FOLL-0009].
- Мозговой мозг , или костномозговой канал, является центральной частью. Стержень волоса, который частично контролируется факторами транскрипции LεF-1/CTF, очень специфически экспрессирует трансглютаминазу-3, а также 15 кератинов [5].
 Уровни экспрессии этих маркеров можно оценить с помощью анализа транскриптома [анализ: FOLL-0004] или иммуногистологического анализа [анализ: FOLL-0003].
Уровни экспрессии этих маркеров можно оценить с помощью анализа транскриптома [анализ: FOLL-0004] или иммуногистологического анализа [анализ: FOLL-0003].
Внутренняя и наружная эпителиальные оболочки
Внутренняя оболочка , состоящая из трех концентрических слоев (называемых слоем Генле, слоем Хаксли и кутикулой), кератинизирована. Дифференцировка его клеток частично зависит от транскрипционного фактора GATA-3. Эти клетки экспрессируют трихогиалин, трансглютаминазы 1 и 5 и кератин hK6irs. Внешняя эпителиальная оболочка представляет собой внешний слой фолликула и экспрессирует множественные кератины.
Мезенхимальный компартментОн включает кожную оболочку и дермальный сосочек:
- Дермальная оболочка представляет собой внеклеточный матрикс, состоящий в основном из коллагена I и III типов и протеогликанов.
- Дермальный сосочек , постоянная единица в основании фолликула, состоит из соединительной ткани и мезенхимальных клеток, называемых дермальными папиллярными фибробластами.
 Эти клетки специфически экспрессируют щелочную фосфатазу, CD133, антиапоптозный белок Bcl-2, циклооксигеназу типа 1, PGE2 и CRABP1. Дермальные папиллярные фибробласты генерируют сигналы, стимулирующие пролиферацию, миграцию и дифференцировку клеток матрикса, которые необходимы для роста волосяного фолликула [Анализ: DPF-0002].
Эти клетки специфически экспрессируют щелочную фосфатазу, CD133, антиапоптозный белок Bcl-2, циклооксигеназу типа 1, PGE2 и CRABP1. Дермальные папиллярные фибробласты генерируют сигналы, стимулирующие пролиферацию, миграцию и дифференцировку клеток матрикса, которые необходимы для роста волосяного фолликула [Анализ: DPF-0002].
Помимо клеток фолликулярной луковицы фибробласты дермального сосочка также могут выступать в качестве резервуара плюрипотентных стволовых клеток, способных дифференцироваться в другие клеточные линии: хондроциты, остеобласты, адипоциты и др. Базальная мембрана обеспечивает разделение эпителиального и кожного отделов. Он богат внеклеточным матриксом, который состоит в основном из коллагена IV, ламинина V, фибронектина и сульфата гепарина [анализ: FOLL-0003].
Сальная железа Сальная железа состоит из себоцитов , эпителиальных клеток, образующих кожное сало. Кожное сало защищает волосы от обезвоживания и играет роль в микробной экосистеме. Себоциты экспрессируют специфические маркеры, такие как K7 и EMA, и продуцируют липиды (триглицериды, воски, сквален, холестерин), которые они высвобождают путем разрыва по завершении дифференцировки [Анализы: SEBOAR-0004; СЕБОАР-0007; СЕБОАР-0019]. Нарушение выработки кожного сала может привести к сухости или жирности волос. Апокринные потовые железы, которые открываются в верхней части волосяных фолликулов, ответственны за запах тела, связанный с потоотделением.
Себоциты экспрессируют специфические маркеры, такие как K7 и EMA, и продуцируют липиды (триглицериды, воски, сквален, холестерин), которые они высвобождают путем разрыва по завершении дифференцировки [Анализы: SEBOAR-0004; СЕБОАР-0007; СЕБОАР-0019]. Нарушение выработки кожного сала может привести к сухости или жирности волос. Апокринные потовые железы, которые открываются в верхней части волосяных фолликулов, ответственны за запах тела, связанный с потоотделением.
Волосяной фолликул: сигнализация и рост клеток
Цикл роста волос состоит из четырех фаз. Переходы тщательно контролируются сложным набором активаторов или ингибиторов растворимых факторов (факторы роста, морфогены). Эти фазы происходят независимо для каждого фолликула, что обеспечивает постоянство волос.
Фаза анагена — это фаза, во время которой волосы увеличиваются в длину (путем образования волосяного стержня). Эта фаза обычно длится в среднем 3 года, в зависимости от индивидуальных особенностей и факторов окружающей среды.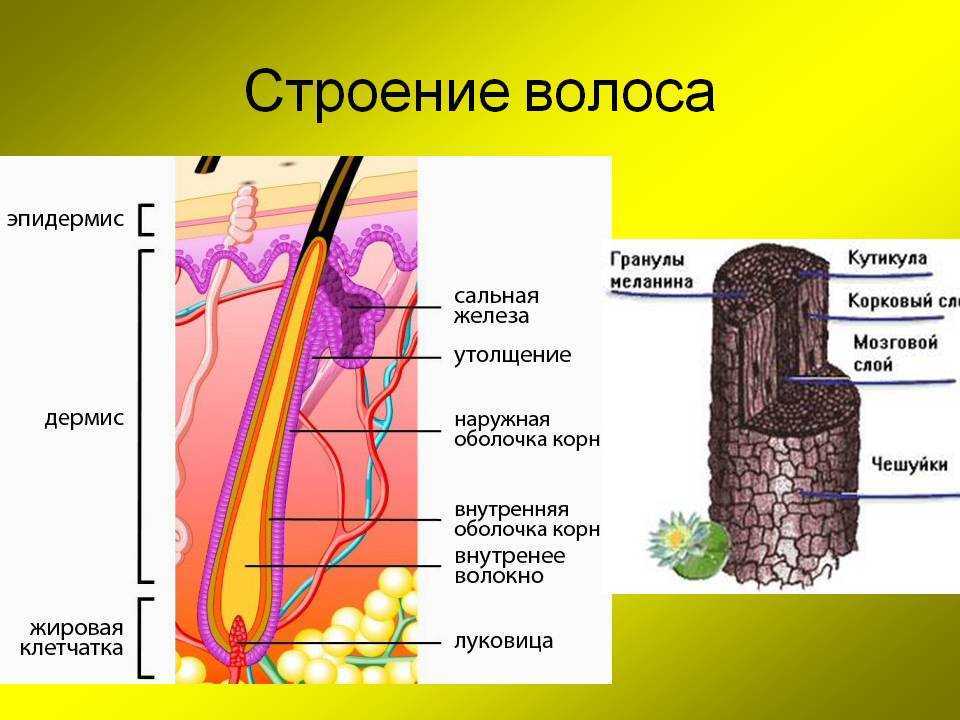 Это относится примерно к 85% волосяных фолликулов. Продолжительность этой фазы, которая определяет длину волос, зависит от продолжающейся пролиферации и дифференцировки клеток матрикса [Анализ: FOLL-0001 и FOLL-0002].
Это относится примерно к 85% волосяных фолликулов. Продолжительность этой фазы, которая определяет длину волос, зависит от продолжающейся пролиферации и дифференцировки клеток матрикса [Анализ: FOLL-0001 и FOLL-0002].
Кинетика роста волос [Анализ: FOLL-0001]
Фаза катагена представляет собой переход между фазами анагена и телогена и контролируется факторами роста, такими как простагландин D2. Эта фаза регрессии длится в среднем три недели, в течение которых рост волос прекращается. Это постепенно приводит к латентной фазе. Во время этой фазы, которая затрагивает от 1 до 2% волосяных фолликулов, эпителиальные клетки в основании фолликула вступают в апоптоз [анализ: FOLL-0002], в то время как клетки дермального сосочка остаются интактными и мигрируют близко к стволовым клеткам волосяных фолликулов. лампа переходит в латентную фазу.
Фаза телогена , первоначально описанная как латентная фаза, которая может длиться до трех месяцев, была переопределена с помощью исследований транскриптома. Это относится примерно к 15 % волосяных фолликулов.
Это относится примерно к 15 % волосяных фолликулов.
Фаза кеногена является латентной фазой, которая систематически не наблюдается в каждом цикле. Это происходит после выпадения волос и длится от двух до пяти месяцев.
В конце цикла все компартменты волосяных фолликулов, за исключением дермального сосочка, разрушаются в результате апоптотического процесса. Начало нового цикла, недавно названного фазой неогена, характеризуется регенерацией фолликула из резервуара плюрипотентных стволовых клеток, которые пролиферируют и дифференцируются под действием различных сигнальных путей (сигнальный путь BMP, сигнальный путь Wnt/β-катенин). путь). Другие факторы роста могут блокировать начало этой фазы.
Похожие сообщения
Захват и профилирование стволовых клеток волосяных фолликулов взрослых Существование базальных клеток лимбального эпителия с медленным циклом, которые можно предпочтительно стимулировать к пролиферации: последствия для эпителиальных стволовых клеток.
 Cell 57 , 201–209 (1989).
Cell 57 , 201–209 (1989).КАС пабмед Google ученый
Цай Р.Дж., Ли Л.М. и Чен Дж.К. Реконструкция поврежденных роговиц путем трансплантации аутологичных клеток лимбального эпителия. Н. англ. Дж. Мед. 343 , 86–93 (2000).
КАС пабмед Google ученый
Бернштейн, И.Д., Эндрюс, Р.Г. и Роули, С. Выделение гемопоэтических стволовых клеток человека. Клетки крови 20 , 15–24 (1994).
КАС пабмед Google ученый
Паус Р. и Котсарелис Г. Биология волосяных фолликулов. Н. англ. Дж. Мед. 341 , 491–497 (1999).
КАС пабмед Google ученый
Котсарелис Г. и Миллар С.Э. К молекулярному пониманию выпадения волос и его лечения. Тенденции мол. Мед. 7 , 293–301 (2001).
Тенденции мол. Мед. 7 , 293–301 (2001).
КАС Google ученый
Коцарелис Г., Сун Т. Т. и Лавкер Р. М. Клетки, сохраняющие метку, находятся в области выпуклости сально-волосяной единицы: значение для фолликулярных стволовых клеток, цикла роста волос и канцерогенеза кожи. Cell 61 , 1329–1337 (1990).
КАС пабмед Google ученый
Lyle, S. et al. Моноклональное антитело C8/144B распознает цитокератин 15 и определяет расположение стволовых клеток волосяного фолликула человека. J. Cell Sci. 111 , 3179–3188 (1998).
КАС пабмед Google ученый
Осима, Х., Рочат, А., Кедзия, К., Кобаяши, К. и Баррандон, Ю. Морфогенез и обновление волосяных фолликулов из взрослых мультипотентных стволовых клеток. Cell 104 , 233–245 (2001).
Cell 104 , 233–245 (2001).
КАС пабмед Google ученый
Моррис Р.Дж. & Potten, C.S. Высокостойкие сохраняющие метку клетки в волосяных фолликулах мышей и их судьба после индукции анагена. Дж. Инвест. Дерматол. 112 , 470–475 (1999).
КАС пабмед Google ученый
Wilson, C. et al. Клетки в области выпуклости волосяного фолликула мыши временно пролиферируют во время раннего анагена: гетерогенность и функциональные различия различных циклов роста волос. Дифференциация 55 , 127–136 (1994).
КАС пабмед Google ученый
Тейлор Г., Лерер М.С., Дженсен П.Дж., Сун Т.Т. и Лавкер Р.М. Участие фолликулярных стволовых клеток в формировании не только фолликула, но и эпидермиса. Cell 102 , 451–461 (2000).
КАС пабмед Google ученый
Тумбар, Т. и др. Определение ниши эпителиальных стволовых клеток в коже. Наука 303 , 359–363 (2004).
КАС пабмед Google ученый
Liu, Y., Lyle, S., Yang, X. & Cotsarelis, G. Промотор кератина 15 нацелен на предполагаемые эпителиальные стволовые клетки в выпуклости волосяного фолликула. Дж. Инвест. Дерматол. 121 , 963–968 (2003).
КАС пабмед Google ученый
Пантелеев А.А., Джахода К.А. и Кристиано, А.М. Предопределение волосяного фолликула. J. Cell Sci. 114 , 3419–3431 (2001).
КАС пабмед Google ученый
Лавкер Р.М. и другие. Стволовые клетки волосяного фолликула. Дж. Расследование. Дерматол. Симп. проц. 8 , 28–38 (2003).
Дж. Расследование. Дерматол. Симп. проц. 8 , 28–38 (2003).
ПабМед Google ученый
Бертон, Т.Р. и другие. Характеристика индуцируемой, специфичной для эпидермиса системы нокаута: дифференциальная экспрессия lacZ в различных линиях репортерных мышей Cre. Бытие 26 , 160–161 (2000).
КАС пабмед Google ученый
Potten, CS & Booth, C. Стволовые клетки кератиноцитов: комментарий. Дж. Инвест. Дерматол. 119 , 888–899 (2002).
КАС пабмед Google ученый
Ватт, Ф.М. Судьба стволовых клеток и формирование паттерна в эпидермисе млекопитающих. Курс. мнение Жене. Дев. 11 , 410–417 (2001).
КАС пабмед Google ученый
Браун, К.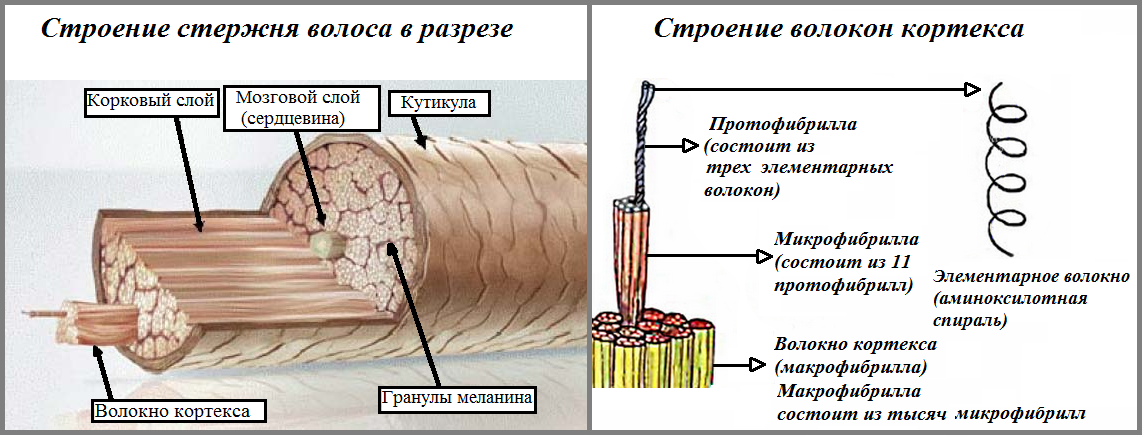 М. и другие. Манипуляции с пролиферацией стволовых клеток и приверженностью клонам: визуализация клеток, сохраняющих метку, в цельных препаратах эпидермиса мыши. Развитие 130 , 5241–5255 (2003).
М. и другие. Манипуляции с пролиферацией стволовых клеток и приверженностью клонам: визуализация клеток, сохраняющих метку, в цельных препаратах эпидермиса мыши. Развитие 130 , 5241–5255 (2003).
КАС пабмед Google ученый
Trempus, C.S. et al. Обогащение живых мышиных кератиноцитов из выпуклости волосяного фолликула маркером клеточной поверхности CD34. Дж. Инвест. Дерматол. 120 , 501–511 (2003).
КАС пабмед Google ученый
Кобаяши К., Роша А. и Баррандон Ю. Сегрегация колониеобразующих клеток кератиноцитов в выпуклости вибриссы крысы. Проц. Натл. акад. науч. США 90 , 7391–7395 (1993).
КАС пабмед ПабМед Центральный Google ученый
Sutherland, HJ, Lansdorp, PM, Henkelman, DH, Eaves, AC & Eaves, CJ Функциональная характеристика отдельных гемопоэтических стволовых клеток человека, культивируемых при предельном разведении на поддерживающих стромальных слоях костного мозга. Проц. Натл. акад. науч. США 87 , 3584–3588 (1990).
Проц. Натл. акад. науч. США 87 , 3584–3588 (1990).
КАС пабмед ПабМед Центральный Google ученый
Камимура Дж., Ли Д., Баден Х.П., Бризетт Дж. и Дотто Г.П. Первичные культуры кератиноцитов мыши содержат клетки-предшественники волосяных фолликулов с потенциалом множественной дифференцировки. Дж. Инвест. Дерматол. 109 , 534–540 (1997).
КАС пабмед Google ученый
Вайнберг, В.К. и другие. Восстановление развития волосяных фолликулов in vivo : определение образования фолликулов, роста и качества волос с помощью клеток дермы. Дж. Инвест. Дерматол. 100 , 229–236 (1993).
КАС пабмед Google ученый
Джахода, К.А., Рейнольдс, А.Дж. и Оливер, Р.Ф. Индукция роста волос в ушных ранах культивируемыми клетками дермального сосочка. Дж. Инвест. Дерматол. 101 , 584–590 (1993).
Дж. Инвест. Дерматол. 101 , 584–590 (1993).
КАС пабмед Google ученый
Иванова Н.Б. и другие. Молекулярная подпись стволовых клеток. Наука 298 , 601–604 (2002).
КАС пабмед Google ученый
Рамальо-Сантос М., Юн С., Мацудзаки Ю., Маллиган Р.К. и Мелтон, Д.А. «Стволовость»: профилирование транскрипции эмбриональных и взрослых стволовых клеток. Наука 298 , 597–600 (2002).
КАС пабмед Google ученый
Ito, M. & Kizawa, K. Экспрессия кальций-связывающих белков S100 A4 и A6 в областях эпителиального мешка, связанных с началом регенерации волосяных фолликулов. Дж. Инвест. Дерматол. 116 , 956–963 (2001).
КАС пабмед Google ученый
Yuen, T.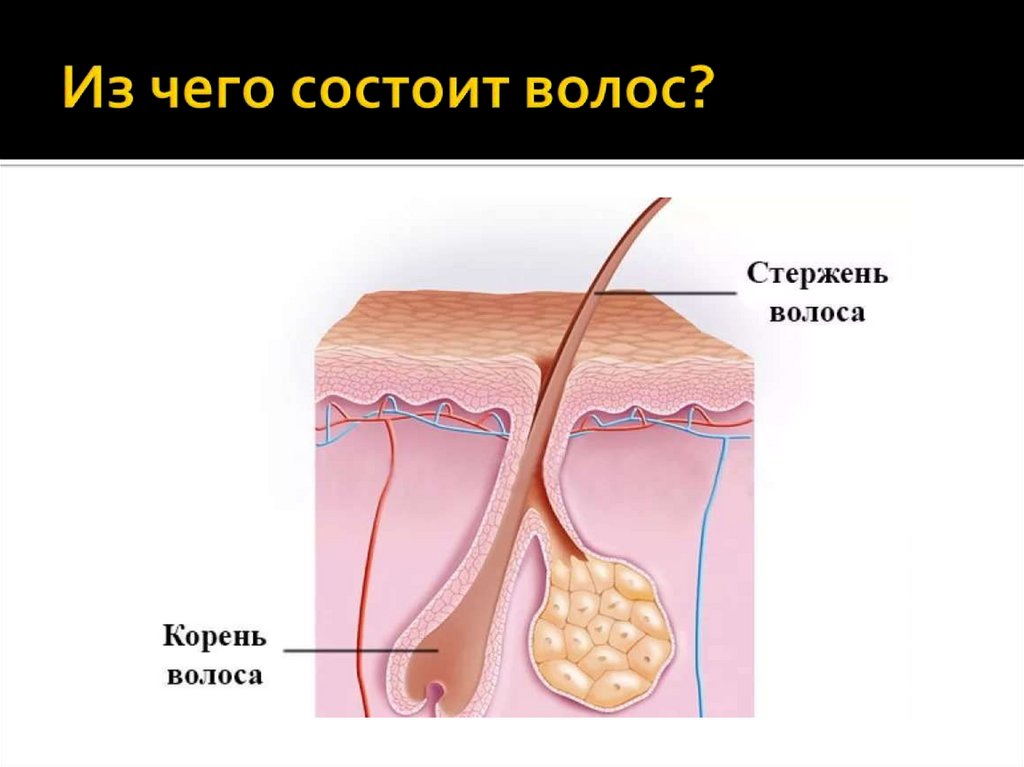 , Wurmbach, E., Pfeffer, R.L., Ebersole, BJ & Sealfon, S.C. Точность и калибровка коммерческих олигонуклеотидных и пользовательских микрочипов кДНК. Рез. нуклеиновых кислот. 30 , е48 (2002).
, Wurmbach, E., Pfeffer, R.L., Ebersole, BJ & Sealfon, S.C. Точность и калибровка коммерческих олигонуклеотидных и пользовательских микрочипов кДНК. Рез. нуклеиновых кислот. 30 , е48 (2002).
ПабМед ПабМед Центральный Google ученый
Tseng, H. & Green, H. Связь базонуклелина со способностью кератиноцитов размножаться и с отсутствием терминальной дифференцировки. J. Cell Biol. 126 , 495–506 (1994).
КАС пабмед Google ученый
Петио, А. и др. Решающая роль для передачи сигналов Fgfr2-IIIb в развитии эпидермиса и формировании паттерна волосяных фолликулов. Развитие 130 , 5493–5501 (2003).
КАС пабмед Google ученый
Huelsken, J., Vogel, R., Erdmann, B., Cotsarelis, G. & Birchmeier, W. Бета-катенин контролирует морфогенез волосяных фолликулов и дифференцировку стволовых клеток в коже. Cell 105 , 533–545 (2001).
Бета-катенин контролирует морфогенез волосяных фолликулов и дифференцировку стволовых клеток в коже. Cell 105 , 533–545 (2001).
КАС пабмед Google ученый
Ван Матер Д., Коллигс Ф.Т., Длугош А.А. & Fearon, ER. Временная активация передачи сигналов бета-катенина в кожных кератиноцитах достаточна для запуска фазы активного роста волосяного цикла у мышей. Гены Дев. 17 , 1219–1224 (2003).
КАС пабмед ПабМед Центральный Google ученый
Мейер Н., Уважаемый Т.Н. & Boehm, T. Whn и mHa3 являются компонентами генетической иерархии, контролирующей дифференцировку волосяных фолликулов. Мех. Дев. 89 , 215–221 (1999).
КАС пабмед Google ученый
Zheng, Y. et al. Scd1 экспрессируется в сальных железах и разрушается у мышей asebia. Нац. Жене. 23 , 268–270 (1999).
Нац. Жене. 23 , 268–270 (1999).
КАС пабмед Google ученый
Кауфман, К.К. и другие. GATA-3: неожиданный регулятор определения клеточного происхождения в коже. Гены Дев. 17 , 2108–2122 (2003 г.).
КАС пабмед ПабМед Центральный Google ученый
Кристоф Т. и др. Особенности иммунной системы волосяных фолликулов человека. Бр. Дж. Дерматол. 142 , 862–873 (2000).
КАС пабмед Google ученый
Яворски К., Клигман А.М. и Мерфи, Г.Ф. Характеристика воспалительных инфильтратов при алопеции по мужскому типу: значение для патогенеза. Бр. Дж. Дерматол. 127 , 239–246 (1992).
КАС пабмед Google ученый
Буль, А.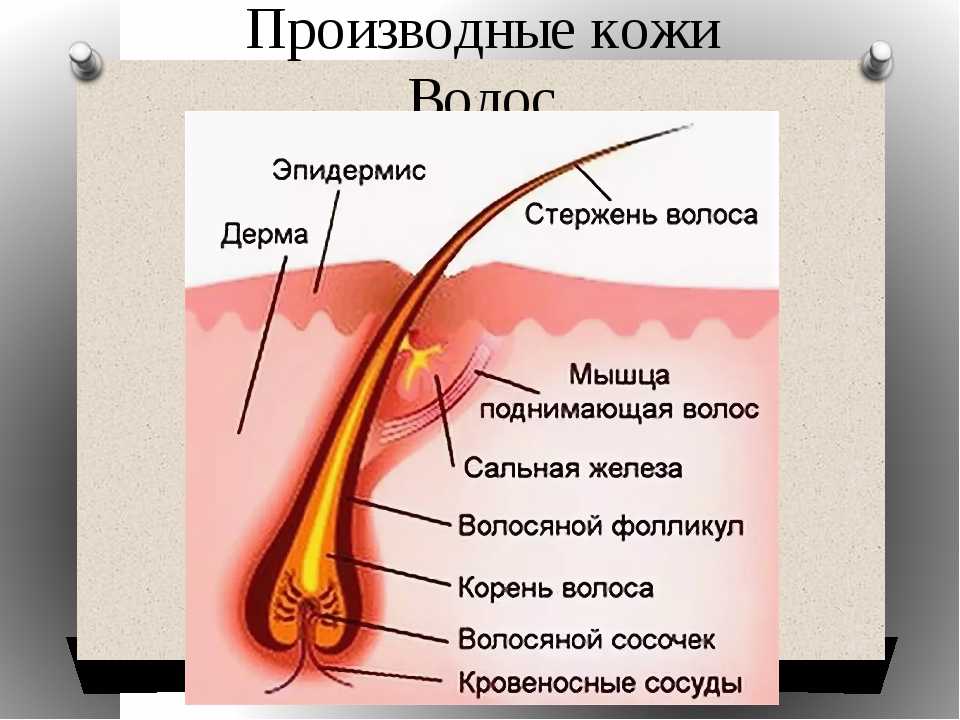 Е., Конрад, С.Дж., Уолдон, Д.Дж. и Брунден, М.Н. Проводимость калиевых каналов как механизм контроля в волосяных фолликулах. Дж. Инвест. Дерматол. 101 , 148С–152С (1993 г.).
Е., Конрад, С.Дж., Уолдон, Д.Дж. и Брунден, М.Н. Проводимость калиевых каналов как механизм контроля в волосяных фолликулах. Дж. Инвест. Дерматол. 101 , 148С–152С (1993 г.).
КАС пабмед Google ученый
Kellendonk, C. et al. Регуляция рекомбиназной активности Cre синтетическим стероидом RU 486. Nucleic Acids Res. 24 , 1404–1411 (1996).
КАС пабмед ПабМед Центральный Google ученый
Паус Р., Стенн К.С. и Линк, Р.Э. Индукция анагенного роста волос в телогеновой коже мышей введением циклоспорина А. Лаборатория Инвест. 60 , 365–369 (1989).
КАС пабмед Google ученый
Моррис Р.Дж., Фишер С.М., Кляйн-Санто А.Дж. и Слага, Т.Дж. Субпопуляции первичных эпидермальных базальных клеток взрослых мышей осаждаются в градиентах плотности.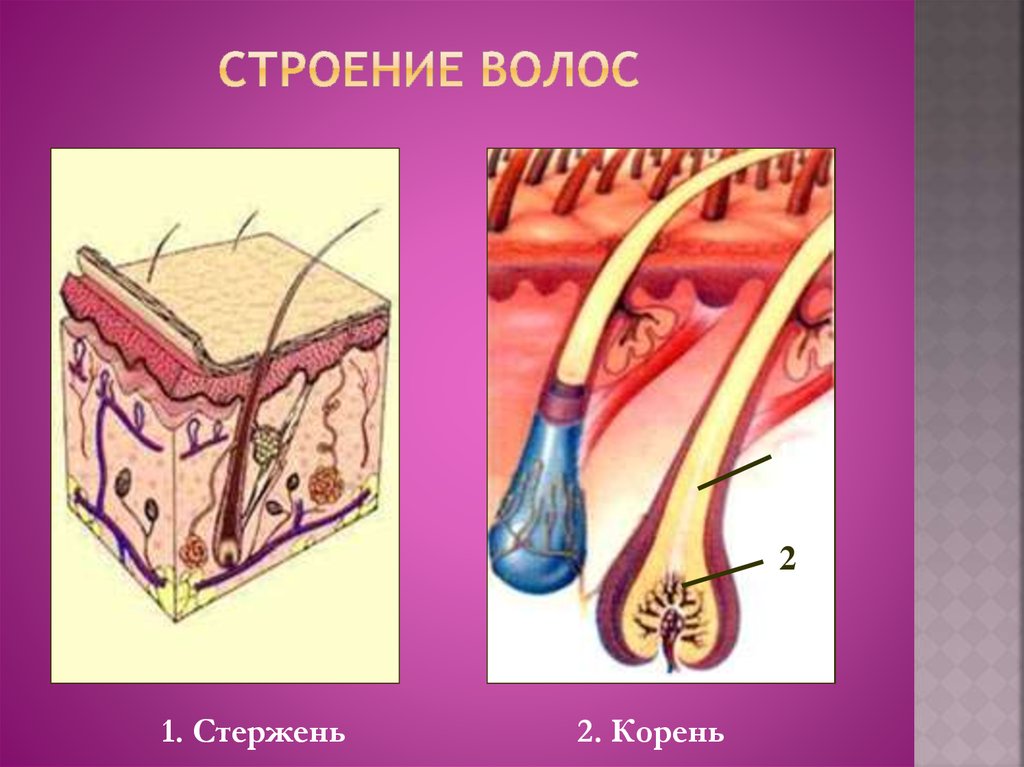 Кинет клеточной ткани. 23 , 587–602 (1990).
Кинет клеточной ткани. 23 , 587–602 (1990).
КАС пабмед Google ученый
Гилмор, С.К., Тети, К.А., Ву, К.К. и Моррис, Р.Дж. Простая система in vivo для изучения эпителизации, образования волосяных фолликулов и инвазии с использованием первичных эпидермальных клеток из кожи мышей дикого типа и трансгенной орнитиндекарбоксилазы со сверхэкспрессией. Дж. Инвест. Дерматол. 117 , 1674–1676 (2001).
КАС пабмед Google ученый
Ли, К. и Вонг, У.Х. Модельный анализ массивов олигонуклеотидов: вычисление индекса экспрессии и обнаружение выбросов. Проц. Натл. акад. науч. США 98 , 31–36 (2001).
КАС пабмед Google ученый
Xu, X., Lyle, S., Liu, Y., Solky, B. & Cotsarelis, G.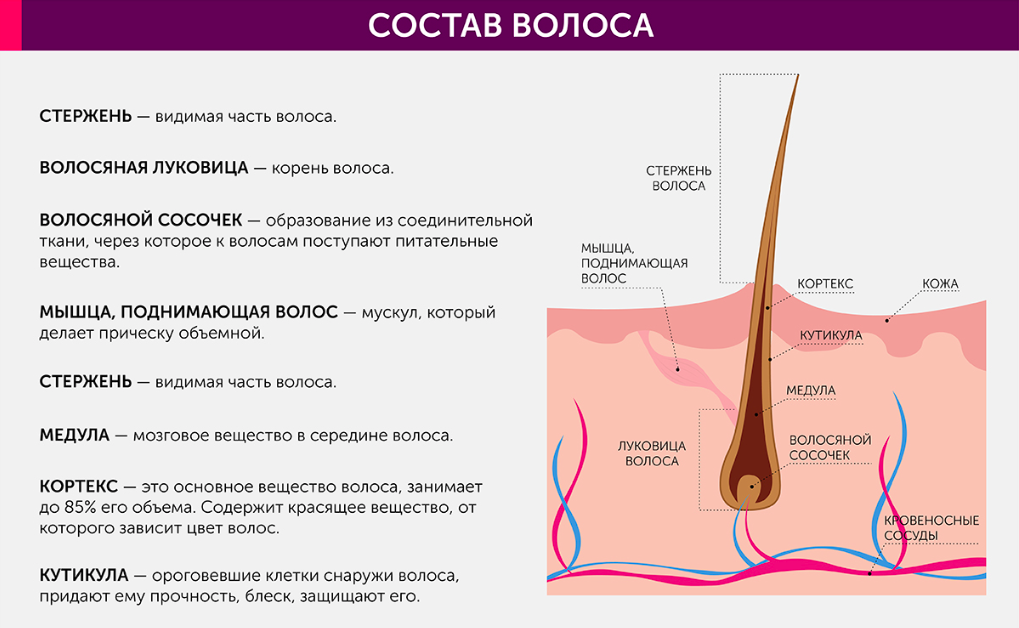

 Уровни экспрессии этих маркеров можно оценить с помощью анализа транскриптома [анализ: FOLL-0004] или иммуногистологического анализа [анализ: FOLL-0003].
Уровни экспрессии этих маркеров можно оценить с помощью анализа транскриптома [анализ: FOLL-0004] или иммуногистологического анализа [анализ: FOLL-0003]. Эти клетки специфически экспрессируют щелочную фосфатазу, CD133, антиапоптозный белок Bcl-2, циклооксигеназу типа 1, PGE2 и CRABP1. Дермальные папиллярные фибробласты генерируют сигналы, стимулирующие пролиферацию, миграцию и дифференцировку клеток матрикса, которые необходимы для роста волосяного фолликула [Анализ: DPF-0002].
Эти клетки специфически экспрессируют щелочную фосфатазу, CD133, антиапоптозный белок Bcl-2, циклооксигеназу типа 1, PGE2 и CRABP1. Дермальные папиллярные фибробласты генерируют сигналы, стимулирующие пролиферацию, миграцию и дифференцировку клеток матрикса, которые необходимы для роста волосяного фолликула [Анализ: DPF-0002].