- Фосфаты, полифосфаты и общий фосфор
- Фосфор в сыворотке
- человечество вымрет, когда закончится природный фосфор? / Авторские материалы / Радиостанция “Вести FM” Прямой эфир/Слушать онлайн
- Фосфорные удобрения | справочник Пестициды.ru
- Сдать анализ на фосфор неорганический
- Российские фосфаты слились из США – Газета Коммерсантъ № 185 (6906) от 09.10.2020
- Анализ крови на неорганический фосфор
- Разница между фосфором и фосфатом
- Фосфат vs.Фосфор – В чем разница?
- Фосфат в анализе крови | Мичиган Медицина
- Purpose, High vs.Низкий и нормальный уровни
- Ортофосфат – обзор | Темы ScienceDirect
- Фосфорные удобрения | UMN Extension
- Фосфор – Информация об элементе, свойства и применение
Фосфаты, полифосфаты и общий фосфор
ФОСФАТЫ, ПОЛИФОСФАТЫ И ОБЩИЙ ФОСФОР [c.207]Результаты определения фосфатов и полифосфатов выражают в миллиграммах РО4 или в миллиграмм-эквивалентах соответствующей ионной формы на I л воды. Результаты определения общего фосфора выражают в миллиграммах фосфат-ионов (РО4 ) на 1 л воды. [c.208]
Метод анализа. Количественное определение соединений, присутствующих в простых смесях фосфатов, полифосфатов и полиметафосфатов, не встречает больших затруднений. Определение ортофосфата, пирофосфата, три-фосфата и так называемого гексаметафосфата в смесях растворимых фосфатов — обычная аналитическая работа. Общее содержание фосфора определяется посредством гидролиза всех остальных фосфатов до ортофосфорной кислоты. Однако четкого аналитического метода, пригодного для прямого количественного определения циклических метафосфатов, не существует. [c.88]
Другая возможность состоит в том, что вещества со сродством к воде отнимали молекулы воды от мономеров путем специфических взаимодействий даже в водной среде.

Фосфаты, полифосфаты Фосфаты Фосфор обший Фосфор общий и органический Химическое потребление кислорода Хром Хром (VI) Цветность Цианиды [c.349]
ФОСФАТЫ, ПОЛИФОСФАТЫ и ОБЩИЙ ФОСФОР [c.210]
Ниже будут изложены методы определения фосфора полифосфатов и общего фосфора метод определения имеющихся в воле ортофосфатов описан выше (см. Определение фосфатов ). Все эти определения следует производить сразу после отбора проб воды если это невозможно, то их консервируют путем добавки 2 мл хлороформа на 1 л воды и сохраняют в холодильнике при. 0°С. Перед анализом воду фильтруют через мембранный фильтр № 2, отбрасывая первые 20 мл фильтрата. Подготовка фильтра описана в разделе Определение органического углерода . В данном случае не следует вносить раздробленной двуокиси кремния или раздробленного кварцевого стекла на мембранный фильтр, так как может привести к обогащению фильтрата растворимой кремниевой кислотой.
Определение фосфатов ). Все эти определения следует производить сразу после отбора проб воды если это невозможно, то их консервируют путем добавки 2 мл хлороформа на 1 л воды и сохраняют в холодильнике при. 0°С. Перед анализом воду фильтруют через мембранный фильтр № 2, отбрасывая первые 20 мл фильтрата. Подготовка фильтра описана в разделе Определение органического углерода . В данном случае не следует вносить раздробленной двуокиси кремния или раздробленного кварцевого стекла на мембранный фильтр, так как может привести к обогащению фильтрата растворимой кремниевой кислотой.
При некоторых способах обработки воды, а также со сточными водами, содержащими синтетические моющие средства, в поверхностные воды могут попадать полифосфаты, которые в естественных условиях медленно гидролизуются до ортофоофатов. Выражение общий фосфор охватывает все виды фосфатов, содержащихся в воде, а именно растворенные и нерастворенные, неорганические и органические связанные фосфаты. [c.216]
[c.216]
Важнейшая форма, в которой фосфор присутствует в водах, — это неорганические растворимые ортофосфаты. Для их определения предлагается колориметрический метод с использованием молибдата и соли сурьмы, а образующееся комплексное соединение восстанавливают аскорбиновой кислотой. Реакцию проводят при комнатной температуре, при которой полифосфаты не гидролизуются и органические фосфаты не разрушаются. Тем же методом определяют гидролизующиеся полифосфаты и общий фосфор после превращения этих соединений в растворимые неорганические ортофосфаты. [c.206]
Фосфор, подобно углероду, образует гомологические ряды фосфатов, близкие по свойствам к гомологическим рядам углерода [133]. Эти ряды составлены из тетраэдров РО4. В зависимости от способа соединения РО4 фосфаты разделяются на полифосфаты — цепные соединения с общей формулой Н +аР 0зп+1, метафосфаты — кольцевые соединения с общей формулой Н Р Оз и ультрафосфаты, построенные из колец и разветвленных цепей. Последние легко гидролизуются с образованием поли- и метафосфатов. [c.16]
Последние легко гидролизуются с образованием поли- и метафосфатов. [c.16]
Содержание полифосфатов рассчитывают по разности после определения общего содержания соединений пятивалентного фосфора. Каждый пз выделенных фосфатов обычно гидролизом превращают в ортофосфат, затем осаждают в виде фосфоромолибдата аммония и титруют едким натром (стр. 180).
Общее содержание фосфатов (общий фосфор) и ортофосфатов в пробах сравнивалось для осени и весны (рис. 15.4). В эти сезоны в сточных водах очистной станции наблюдалось значительное уменьшение содержания общего фосфора. Весной наблюдалось уменьшение содержания ортофосфата при прохождении сточных вод через очистную станцию, но осенью было зарегистрировано небольшое увеличение количества ортофосфата, что, возможно, вызвано превращением полифосфатов в процессе очистки в ортофосфаты. В любом 1случае содержание фосфора в виде ортофосфатов уменьшалось до время достижения сточными водами 10-метровой глубины. Летом и осенью содержание общего фосфора довольно значительно уменьшалось, достигая минимума на глубине 3 м. Затем следовало увеличение концентрации до глубины 8 м. Весной изменение содержания общего фосфора было аналогично изменению содержания [c.167]
Летом и осенью содержание общего фосфора довольно значительно уменьшалось, достигая минимума на глубине 3 м. Затем следовало увеличение концентрации до глубины 8 м. Весной изменение содержания общего фосфора было аналогично изменению содержания [c.167]
В Центральном плесе пробы воды для опытов отбирали из поверхностного слоя с мая по август 1989 г. Водам этого плеса свойственно сравнительно низкое содержание общего фосфора, высокое отношение N Р и преобладание деструкционных процессов над продукционными (табл. 2). Кроме экспериментов по накоплению полифосфатов в сестоне изучали влияние добавки фосфатов на интенсивность деструкционных процессов. С этой целью определяли БПКб в натуральной и фильтрованной воде с добавкой и без добавки РО4. [c.93]
Внутриклеточная трансформация поглощенных фосфатов в разные сроки наблюдений была различна. В мае и начале июня прибавка полифосфатов была незначительной (табл.
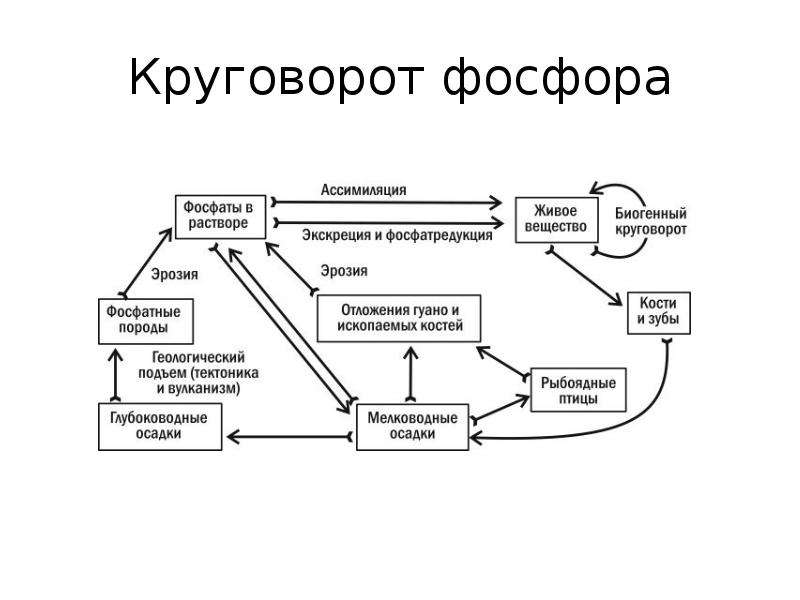 4) увеличение общего фосфора в сестоне в основном произошло за счет стойких органических соединений (табл. 5). Это позволяет полагать, что образующиеся полифосфаты во время экспозиции трансформировались в органические соединения, главным образом в РНК. Такой ход превращений имеет место при отсутствии дефицита. Б середине июня—июле количество полифосфатов в сестоне существенно возросло (см. табл. 4). В этот период превращение поглощенных фосфатов в макрофитопланктоне шло по линии накопления полифосфатов без перехода в стойкие органические соединения (табл. 5). Особенно высокий уровень полифосфатов (70 % общего фосфора в сестоне) в конце экспозиции, свидетельствующий об остром дефиците Р, наблюдался в пробе от
4) увеличение общего фосфора в сестоне в основном произошло за счет стойких органических соединений (табл. 5). Это позволяет полагать, что образующиеся полифосфаты во время экспозиции трансформировались в органические соединения, главным образом в РНК. Такой ход превращений имеет место при отсутствии дефицита. Б середине июня—июле количество полифосфатов в сестоне существенно возросло (см. табл. 4). В этот период превращение поглощенных фосфатов в макрофитопланктоне шло по линии накопления полифосфатов без перехода в стойкие органические соединения (табл. 5). Особенно высокий уровень полифосфатов (70 % общего фосфора в сестоне) в конце экспозиции, свидетельствующий об остром дефиците Р, наблюдался в пробе от Наибольшее значение среди линейных полифосфатов имеют тетрафосфат натрия и калгон (соль Грахамса — смесь высших полифосфатов, содержащих в молекуле 13—25 атомов фосфора, часто ошибочно называемая гексаметафосфат , как можно называть только циклические фосфаты).
В экспериментах с добавками фосфатов общее содержание фосфора в сестоне пелагиали возрастало, но в отличие от опытов с водой литоральной зоны эта прибыль почти во всех пробах была меньше количества поглощенных из воды фосфатов (табл. 6). Это свидетельствует об активном потреблении фосфатов бактерио-планктоном, заметно превышающем поступление РО в результате микробиальной деструкции органического вещества. В пользу высокой интенсивности микробиальных процессов говорит и заметное снижение фосфора в стойких органических соединениях сестона при одновременном увеличении в его составе фракции полифосфатов (табл. 7, 8). Накопление полифосфатов в сестоне без [c.99]
Фосфор в сыворотке
Фосфор – жизненно важный для человека микроэлемент, являющийся основной составляющей всех клеток организма. Он участвует в большинстве обменных процессов организма и необходим для формирования тканей (особенно нервной и костной).
Синонимы русские
Фосфор неорганический.
Синонимы английские
Inorganic Phosphate, Phosphorus, Serum P, PO4, Phosphate.
Метод исследования
Колориметрия с молибдатом аммония.
Единицы измерения
Ммоль/л (миллимоль на литр).
Какой биоматериал можно использовать для исследования?
Венозную, капиллярную кровь.
Как правильно подготовиться к иследованию?
Не принимать пищу в течение 2-3 часов перед исследованием, можно пить чистую негазированную воду.
Общая информация об исследовании
Фосфор – это минерал, находящийся в организме в виде органических и неорганических соединений. Термины “фосфор” и “фосфаты” взаимозаменяемы, когда говорится о проверке уровня вещества в организме, однако стоит учитывать, что подсчитывается количество неорганического фосфата.Фосфор необходим организму для производства энергии, выполнения функций мышечной и нервной системы, а также для роста костей. Фосфаты, являясь своеобразным буфером, играют важную роль в поддержании кислотно-щелочного баланса.
Фосфаты, являясь своеобразным буфером, играют важную роль в поддержании кислотно-щелочного баланса.
Фосфор попадает в организм с пищей. Находясь в составе многих продуктов питания, он достаточно быстро всасывается в тонком кишечнике. Около 70-80 % фосфора в организме связано с кальцием, формируя каркас костей и зубов, 10 % находится в мышцах и около 1 % в нервной ткани. Оставшаяся часть содержится во всех клетках организма в качестве запаса энергии. В норме около 1 % всего фосфора находится в крови. Многие продукты питания (фасоль, горошек, орехи, злаки, растительные масла, яйца, говядина, курица, рыба) содержат значительное количество фосфатов. Стабильная концентрация фосфора поддерживается регуляцией процессов всасывания в кишечнике и выделения в почках. К тому же уровень фосфатов зависит от количества паратиреоидного гормона, кальция и витамина D.
К недостатку фосфора (гипофосфатемии) приводят расстройства кислотно-щелочного баланса, неполноценность питания, мальабсорбция, гиперкальциемия и нарушения, влияющие на процессы выделения в почках. Причиной избытка фосфора (гиперфосфатемии) может быть чрезмерное поступление минерала с пищей, гипокальциемия и поражение почек.
Причиной избытка фосфора (гиперфосфатемии) может быть чрезмерное поступление минерала с пищей, гипокальциемия и поражение почек.
У людей с умеренным дефицитом этого минерала симптомы его недостаточности могут не проявляться. О сильной нехватке фосфора говорит мышечная слабость и спутанность сознания. Интересно, что признаки избытка фосфора похожи на симптомы недостаточности кальция: мышечные судороги, оцепенение, потеря сознания.
Фосфорный и кальциевый обмены тесно взаимосвязаны: при понижении концентрации кальция уровень фосфора повышается, повышенная концентрация одного электролита в плазме ведет к усиленному выделению почками с мочой другого. Многие факторы, увеличивающие содержание кальция, снижают уровень фосфора.
Для чего используется исследование?
Для диагностики различных патологических состояний, вызывающих нарушения фосфорно-кальциевого обмена, и контроля за их лечением (совместно с проверкой уровня кальция, паратиреоидного гормона и/или витамина D).
Когда назначается исследование?
- В качестве дополнительного исследования при гипо- или гиперкальциемии (так как умеренный недостаток или избыток фосфора может не проявляться).
- При симптомах патологии почек и/или желудочно-кишечного тракта.
- Регулярно, когда уже диагностированы патологические состояния, вызывающие значительные изменения уровня фосфора и/или кальция (для контроля за эффективностью их лечения).
- При сахарном диабете или признаках нарушения кислотно-щелочного баланса.
Что означают результаты?
Референсные значения
|
Возраст |
Референсные значения |
|
1,45 – 2,16 ммоль/л |
|
|
2 – 12 лет |
1,45 – 1,78 ммоль/л |
|
> 12 лет |
0,81 – 1,45 ммоль/л |
Низкий уровень фосфора может быть вызван:
- передозировкой диуретиков (бесконтрольной потерей фосфатов с мочой),
- недостаточным поступлением фосфора с пищей,
- алкоголизмом (чаще всего при этом есть еще ферментная недостаточность, нарушения питания и всасывания),
- ожоговой болезнью (соответственно, нарушением баланса многих видов обмена и излишней потерей электролитов и жидкости с пораженной поверхности),
- диабетическим кетоацидозом (из-за усиления метаболизма углеводов),
- гипер- или гипотиреозом,
- гипокалиемией,
- постоянным применением антацидов,
- рахитом (у детей) и остеомаляцией (у взрослых),
- гиперинсулинизмом (инсулин участвует в транспорте глюкозы в клетки, невозможном без фосфатов),
- заболеваниями печени,
- септицемией,
- сильной рвотой и/или диареей.

Высокий уровень фосфора (гиперфосфатемия) чаще всего связан с нарушением функции почек и уремией. Его причинами могут быть:
- почечная недостаточность, любой тяжелый нефрит (с повышением уровня креатинина и мочевины),
- гипопаратиреоз,
- остеосаркомы, метастатическое поражение костей и миеломная болезнь,
- диабетический кетоацидоз,
- передозировка фосфоросодержащими препаратами,
- переломы в стадии заживления,
- передозировка витамина D,
- болезнь Аддисона (недостаточная выработка гормонов надпочечниками),
- акромегалия.
Что может влиять на результат?
- Прием пищи перед сдачей крови может приводить к ложному понижению уровня фосфора.
- Уровень фосфора в крови, взятой вечером, будет выше результата от утреннего образца (из-за суточных колебаний концентрации минерала).
- Гемодиализ способствует понижению концентрации фосфора.

- Лекарственные препараты, повышающие уровень фосфора: анаболические стероиды, андрогены, бета-адренергические блокаторы, этанол, эргокальциферол, фуросемид, гормон роста, гипотиазид, фосфоросодержащие препараты, витамин D, тетрациклин, метициллин, инъекционные контрацептивы.
- Лекарственные препараты, понижающие уровень фосфора: диакарб, антациды, содержащие алюминий, аминокислоты, анестетики, кальцитонин, карбамазепин, адреналин, эстрогены, глюкокортикоиды, инсулин, изониазид, пероральные контрацептивы, фенитоин, сукральфат, маннитол.
Важные замечания
- Постоянно высокий уровень фосфора опасен повреждением органов из-за кальцификации (отложения фосфата кальция в тканях).
- В норме концентрация фосфора выше у детей, чем у взрослых. Это связано с повышенной секрецией гормона роста вплоть до пубертатного периода.
- После приема слабительных, содержащих фосфат натрия, уровень фосфора через 2-3 часа возрастает.
 Хотя подъем временный (на 5-6 часов), этот фактор должен учитываться при невозможности объяснить причину повышения концентрации фосфора ничем другим.
Хотя подъем временный (на 5-6 часов), этот фактор должен учитываться при невозможности объяснить причину повышения концентрации фосфора ничем другим. - Избыточное введение витамина D, а также внутривенное введение глюкозы могут повлиять на уровень фосфора в крови и в моче (фосфаты способствуют перемещению глюкозы в клетки).
- Чаще всего изменения уровня фосфора выявляются при поиске причин изменения концентрации кальция.
- При интерпретации причин отклонения от нормы концентрации фосфора стоит брать во внимание и уровень кальция.
Также рекомендуется
Кто назначает исследование?
Терапевт, уролог, нефролог, эндокринолог, гастроэнтеролог, диетолог, гинеколог, педиатр.
человечество вымрет, когда закончится природный фосфор? / Авторские материалы / Радиостанция “Вести FM” Прямой эфир/Слушать онлайн
Конец человечеству придет из-за дефицита фосфора. К такому выводу пришла международная группа ученных. Все из-за того, что человек из земли забирает огромное количество этого минерала для производства удобрений. При этом ресурс не возобновляется. Поэтому необходимо искать новые источники. О новой угрозе для мира расскажет корреспондент «Вестей ФМ» Андрей Хохлов.
К такому выводу пришла международная группа ученных. Все из-за того, что человек из земли забирает огромное количество этого минерала для производства удобрений. При этом ресурс не возобновляется. Поэтому необходимо искать новые источники. О новой угрозе для мира расскажет корреспондент «Вестей ФМ» Андрей Хохлов.
Крепкие дубы, зеленые луга, где гуляет крупный рогатый скот, теплицы, наполненные овощами, – так сейчас выглядит ранчо Джека Хейзена во Флориде в округе Брэдфорд. Ежегодно ранчо приносит ему неплохой доход – за килограмм телятины магазины платят по 10 долларов.
Джек получил землю по наследству от своего отца лет 40 назад. Тогда она представляла собой чуть ли не пустыню с редким сухим кустарником – о пастбищах речи тогда быть не могло. Округ пустел на глазах – люди уезжали, и города становились захолустьями, вспоминает плантатор.
ХЕЙЗЕН: Брэдфорд и его округ всегда были бедными территориями. И я решил нанять 200 человек, чтобы организовать ранчо, оно бы подняло все здесь на ноги. Для этого я принял, похоже, единственное верное решение – насытить почву фосфатами.
Для этого я принял, похоже, единственное верное решение – насытить почву фосфатами.
И это помогло. Фосфаты оживили все вокруг – трава стала пригодной для рогатого скота, а сельскохозяйственные культуры стали расти как на дрожжах, продолжает фермер.
ХЕЙЗЕН: Фосфаты – это не столько витамин, сколько необходимый ресурс для того, чтобы поддерживать жизнь. Никакая форма жизни не может существовать без них.
Удобрение Джек Хейзен взял недалеко от своей фермы. Прямо в середине штата Флорида – между Брэдфордом и округом Юнион – находится шахта, где и добывают фосфат. Ежедневно огромный ковш врезается в почву и достает оттуда минерал под названием фосфорит – горная порода, которая миллионы лет формировалась под землей из останков растений и продуктов жизнедеятельности древних животных. Потом из добытого выделяют фосфор и насыщают кислородом – так и получается фосфат.
Шахта во Флориде – одно из самых крупных мест добычи фосфора в мире. По оценкам Геологической службы США, здесь более 70 миллиардов тонн этого минерала.
Кроме Соединенных Штатов, такими богатствами могут похвастаться только Марокко, Китай, Иордания и Южная Африка. Каждый год здесь достают из-под земли 240 000 тонн этого минерала. И эта цифра регулярно растет. Например, Китай за последние 15 лет нарастил объем добычи с 30 000 до 120 000 тонн в год. Стоимость одной тонны фосфатной руды на мировом рынке варьируется от 100 до 400 долларов. Более 50% мировой добычи закупают страны Юго-восточной Азии.
Спрос на него из года в год растет на 3% – по мере роста населения нашей планеты. По некоторым прогнозам, к 2050 году количество людей на Земле достигнет 9 миллиардов. Для того чтобы прокормиться, потребуется на 70% больше продовольствия, чем у нас есть сегодня. В этом вопросе фосфор приобретает решающее значение.
Но, как и любой ресурс на Земле, фосфор может закончиться, уверяют ученые. Например, в той же Флориде, по оценкам специалистов, минерала хватит только на 25 лет. Когда запасы подойдут к концу, США придется импортировать этот ресурс. В принципе часть фосфатных удобрений Америка уже закупает у Марокко. Что касается всего мира, одни исследователи предсказывают, что фосфора хватит еще на 40 лет, другие настроены более оптимистично – на 80 лет. Третьи успокаивают: у человечества есть еще 400 лет спокойной жизни.
В принципе часть фосфатных удобрений Америка уже закупает у Марокко. Что касается всего мира, одни исследователи предсказывают, что фосфора хватит еще на 40 лет, другие настроены более оптимистично – на 80 лет. Третьи успокаивают: у человечества есть еще 400 лет спокойной жизни.
В любом случае нам необходимо думать о будущем, заявляют ученые. А значит – более экономно использовать этот ресурс. Сегодня большая часть фосфора тратится впустую. 40% уже теряется на этапе переработки – сбрасывается как излишек производства. Он попадает в ближайшие реки и озера. От этого они становятся зеленого цвета. Оттенок дают водоросли, которые там сначала из-за наличия фосфора бурно цветут, а потом, выжав из водоема весь кислород, делают его мертвой зоной, где никто и ничто не может жить.
Например, в штате Флорида жители округа Юнион, расположенного возле шахты, уже несколько лет жалуются: из-за добычи фосфора в реке умирает рыба. Все дело в том, что излишки фосфоритной руды сваливают в специально вырытые стоковые озера – образно говоря, огромные мусорные ямы, заполненные водой. Периодически там происходят утечки. После очередной Кристи Симпсон пришлось даже покинуть свое ранчо и уехать из округа навсегда.
Периодически там происходят утечки. После очередной Кристи Симпсон пришлось даже покинуть свое ранчо и уехать из округа навсегда.
СИМПСОН: Я прожила там до 2004 года. Потом мне пришлось оттуда переехать. На это решение повлиял случай, когда я принимала душ. Я почувствовала, что вода пахнет керосином, да так сильно, что можно сказать – душевая кабина стала некой газовой камерой. Мне пришлось поспешно покинуть это место.
Ежегодно США на устранение протечек тратят более 2 миллиардов долларов. Не это ли – небрежное отношение к такому ресурсу, отмечают ученые. Чтобы избежать загрязнений и возможного опустошения залежей, исследователи советуют найти альтернативный источник фосфора. Таковым могут служить канализационные воды, считают британские специалисты. В 2013 году одна компания открыла завод в городе Беркшир. Предприятие забирает канализационную воду и превращает наши отходы в удобрение ничуть не хуже тех, что добыли из недр земли. За год получается скопить 150 тонн фосфата, которые компания продает местным фермерам. Этому примеру последовала одна голландская компания. Эксперты уверяют, что так можно покрыть все потребности страны в фосфате.
Этому примеру последовала одна голландская компания. Эксперты уверяют, что так можно покрыть все потребности страны в фосфате.
Специалист сельскохозяйственного исследовательского центра Великобритании Мартин Блэквел выяснил, что фосфат можно производить путем растворения рогов и костей животный в соляной кислоте. Теоретически таким способом можно покрыть 15 – 20% потребности всей Великобритании. Если все изыскания в этой области продолжатся, надеются ученые, то вскоре дефицит фосфора исчезнет, и мы сможем преодолеть назревающий продовольственный кризис.
Фосфорные удобрения | справочник Пестициды.ru
Фосфорные удобрения – удобрения, содержащие в качестве основного питательного элемента фосфор. Различают три группы: водорастворимые, цитратно-лимоннорастворимые, труднорастворимые фосфорные удобрения. Применяются они в основной прием, при припосевном внесении и при подкормках. Основное сырье для производства – природные фосфаты (апатиты и фосфориты различных месторождений). [5]
[5]
Классификация фосфорных удобрений
содержат водорастворимые фосфорные соединения, легко доступные растениям.К этой группе относятся суперфосфаты. По способу производства и содержанию P2O5 суперфосфаты делятся на простые и двойные (тройные), по консистенции – на гранулированные и порошковидные.[2]
- Суперфосфат простой (СаН2РО4)2 х Н2О + 2СаSО4 х 2Н2О в порошковидной форме содержит 19 % усвояемого фосфора, а гранулированный – не менее 20 %. Кроме того, удобрение содержит 50–55 % СаSО4. Наличие серы благоприятно сказывается на урожайности культур, положительно реагирующих на серу (рапса, капусты, брюквы, турнепса и др.), а также картофеля.[1]
- Суперфосфат двойной Са(Н2РО4)2 х Н2О производится в гранулированном виде, содержит 43 и 49% P2O5, в зависимости от марки.
 Свободная кислота в составе удобрения не превышает 2,5–5 %. Положительно влияет на рост и развитие всех сельскохозяйственных культур.[1]
Свободная кислота в составе удобрения не превышает 2,5–5 %. Положительно влияет на рост и развитие всех сельскохозяйственных культур.[1] - Суперфос – удобрение фосфорное концентрированное. Содержание P2O5 – 38–40 %. Половина соединений фосфора находится в водорастворимой форме. Получают путем химического воздействия на фосфоритную муку смеси серной и фосфорной кислот. Выпускается в гранулированном виде. По агрономической эффективности превосходит суперфосфаты.[2]
- Преципитат СаНРО4 х 2Н2О содержит 27–38 % Р2О5. Внешне это порошок светло-серого или белого цвета. Получают путем нейтрализации фосфорной кислоты известковым молоком либо мелом и как отход желатинового производства.
 Растворим в лимоннокислом аммонии и хорошо усваивается растениями. Применяется для основного внесения.[5] Используется для добавки в корма.[5]
Растворим в лимоннокислом аммонии и хорошо усваивается растениями. Применяется для основного внесения.[5] Используется для добавки в корма.[5] - Термофосфаты Nа2О х 3СаО х Р2О5 + SiО2 содержат 20–30 % фосфора в лимоннорастворимой форме. К этой группе удобрений относят томасшлак, мартеновский шлак, обесфторенный фосфат. Возможно производство из природных фосфатов, не пригодных для внесения в почву и трудно поддающихся химическому воздействию, с целью получения водорастворимых фосфорных удобрений.
Термофосфаты распространены в Западной Европе. В Германии это ренаний–фосфат, содержащий 25–30 % Р2О5. Получают спеканием фосфоритов с содой (20 %) и добавкой доменного шлака. Во Франции фоспаль (27–29 % Р2О5). Это плавленый фосфат. Получается из сенегальского алюмокальций фосфата при прокаливании при относительно невысоких температурах (550–600°C).[1]
- Костяная мука – удобрение более эффективное, чем фосфоритная мука. Содержит 30–35 % Р2О5 и 1 % азота. Эффективна на кислых почвах, и даже на слабокислых оказывает значительное влияние на урожайность. Является побочным продуктом переработки костей.[2]
- Фосфоритная мука – тяжелый порошок темно-серого цвета. Получают путем размола фосфоритов. Выпускается четыре марки. Содержание Р2О5 – 20, 23, 26 и 29 %. Диаметр частиц – не более 0.18 мм. Это медленно действующее удобрение применяется при основном внесении и фосфоритовании почвы.[1]
- Вивианит (болотная руда) Fe3(РО4)2 х 8 Н2О – мелкий порошок. Удобен для рассеивания. В чистом виде содержит 28 % Р2О5, с примесью торфа (торфовивианит) – 12–26 % Р2О5. Залежи вивианита встречаются в виде небольших гнезд или прослоек массы белесого цвета. На воздухе синеет. После добычи массу проветривают и подсушивают.[1]
Сахар
Суперфосфат используют для получения сахара
Использовано изображение:[8]
Применение
Сельское хозяйство
Фосфорные удобрения применяют для повышения плодородия почвы, в частности, для увеличения содержания фосфора и доступных растениям фосфорных соединений. Кроме того, преципитат, обесфторенный фосфат, костную муку применяют для минеральной подкормки животных.[5]
Промышленность
Суперфосфат используют в дрожжевой и сахарной промышленности (фото). В строительстве он применяется для огнезащитного покрытия древесины.
Двойной суперфосфат используют в химической промышленности в качестве источника фосфора и для приготовления тукосмесей.[3]
Поведение в почве
Поведение фосфорных удобрений в почве зависит не только от вида удобрения, но и от физико-химических процессов, проходящих в самой почве.
При внесении они растворяются, и фосфат-ион постепенно переходит в различные соединения, присущие данному типу почв. Процесс этот медленный. Частично внесенные фосфатные удобрения (гранулированные, полурастворимые и нерастворимые) длительно сохраняются в почве в неизменном виде.
Виды фосфорных удобрений
Трансформация фосфора удобрений обусловлена следующими процессами:
- Обменным (коллоидно-химическим) поглощением фосфора твердой фазой почвы.
Этот процесс наблюдается на поверхности гидратов полуторных оксидов (положительно заряженных коллоидных частиц) или на положительно заряженных участках отрицательно заряженных коллоидов (минералов каолинитовой и монтмориллонитовой групп, гидрослюд, коллоидов белковых групп). Обменное поглощение сильнее выражается в условиях кислой среды. Реакция среды вызывает изменение электрического потенциала почвенных коллоидов. Подкисление почвенного раствора благотворно влияет на большее поглощение анионов. Подщелачивание приводит к обратному результату. В почвах со слабокислой и нейтральной реакцией обменное поглощение выражено гораздо слабее.
Обменно-поглощенные ионы путем десорбции легко вытесняются в раствор другими анионами минеральных и органических кислот. Данные вещества всегда присутствуют в почвенном растворе, и недостатка в них не испытывает ни один тип почвы. Это и определяет высокую подвижность обменно-поглощенных фосфатов в почвах и, как следствие, их доступность растениям.
По своей доступности обменно-поглощенные фосфаты приравниваются к водорастворимым.[5]
- Поглощением фосфора катионами кальция, магния, оксидами и гидроксидами железа, алюминия, марганца и титана по типу химического связывания.
Химическому поглощению в почвах подвергаются и водорастворимые фосфат-ионы удобрений, и фосфат-ионы, перешедшие в раствор из обменно-поглощенного состояния в результате десорбции. Ход и тип химического поглощения обусловливается типом почвы и степенью ее кислотности.
Величина кислотности почвы определяет растворимость солей различных металлов (магния, алюминия, кальция, железа, титана и др.). Взаимодействуя с растворимыми фосфат-ионами, эти соли переводят их в труднорастворимые соединения. Установлено, что наименьшее связывание фосфатов и их максимальная подвижность наблюдаются в интервале pH5,0–5,5. На более кислых почвах фосфат-ионы поглощаются оксидами железа и алюминия, на менее кислых – кальция и магния.
На почвах с нейтральной реакцией среды водорастворимые фосфорные удобрения в результате химического поглощения превращаются в двузамещенные фосфаты кальция и магния (CaHPO4 x 2H2O или MgHPO4 и долгое время остаются именно в таком доступном для растений виде. В дальнейшем ион водорода постепенно замещается кальцием или магнием и образуются трехзамещенные фосфаты этих элементов (Ca3(PO4)2 или Mg3(PO4)2. С течением времени образуются и более основные фосфаты типа октакальцийфосфата (Ca4H(PO4)3 x 3H2O) – это еще менее растворимое соединение. Однако данные соли, находясь в свежеосажденном аморфном состоянии, сохраняют свойство растворяться в слабых кислотах и остаются частично доступными для растений. По мере ретрограции (старения) и перехода из аморфного в кристаллическое состояние фосфаты становятся недоступными для большинства растений.
В дерново-подзолистых почвах с кислой и слабокислой средой основными компонентами химического связывания фосфат-ионов из водорастворимых удобрений являются полуторные оксиды:
Al(OH)3 + H3PO 4 → AlPO4 + 3H2O
Fe(OH)3 + H3PO4 → FePO4 + 3H2O
Опытным путем установлено, что ранее не использованный («остаточный») фосфор хорошо доступен растениям. В почве фосфаты удобрений не закрепляются намертво в значительных количествах. Более того, при дефиците фосфорных удобрений происходит мобилизация фосфатных ресурсов почвы. При этом происходит постепенная трансформация труднорастворимых фосфатов в более растворимые.[5]
- Биологическим поглощением фосфора растениями и микрофлорой почвы.
Биологическое поглощение фосфора растениями возможно только из солей ортофосфорной кислоты. Ортофосфорная кислота является трехосновной и может отдиссоциировать три аниона: H2PO4–, HPO42- и PO43-. В условиях слабокислой реакции среды, в которой чаще всего и растут растения, наиболее доступным является первый из перечисленных ионов, второй – в меньшей степени, третий практически не доступен.
Все соли ортофосфорной кислоты и одновалентных катионов (NH4+, Na+, K+), а также однозамещенные соли двухвалентных катионов (Ca(H2PO4)2 и Mg(H2PO4)2) растворимы в воде и легко усваиваются растениями и микрофлорой почвы.[5]
Применение на различных типах почв
Особенности применения фосфорных удобрений для различных почв зависят от растворимости фосфорных соединений:
- Фосфаты, растворимые в воде, применяются на всех почвах, под все культуры и в разные приемы.
- Эффективность применения фосфатов, растворимых в слабых кислотах (цитратно- и лимоннорастворимые фосфорные удобрения), на кислых почвах сильнее.
- Труднорастворимые удобрения эффективны на почвах с кислой реакцией. К ним относятся почвы нечерноземной зоны и северные черноземы (деградированные и выщелоченные).[2]
Хлопок – фосфоролюбивая культура
Использовано изображение:[7]
Влияние на сельскохозяйственные культуры
лучше отзывается на внесение фосфора, калия и извести, чем азотных удобрений. . Внесение фосфора наряду с известью и азотом значительно увеличивает их кормовую ценность. . (фото) Использование удобрений с повышенным содержанием фосфора повышает урожайность, а при совместном внесении с калием ускоряет созревание урожая. значительно увеличивают урожайность при использовании фосфорных удобрений. . Урожайность увеличивается, повышается качество продукции.[4]Способы внесения
Фосфорные удобрения применяются в большей части при основном способе внесения. Все виды суперфосфатов наиболее эффективны при сочетании основного и припосевного внесения в рядки.
Фосфоритную муку используют для фосфоритования почвы.[5]
АпатитАпатит
Апатит
Использовано изображение:[6]
Получение
Получают фосфорные удобрения из природных фосфорных руд. Они подразделяются на две группы: апатиты (фото) и фосфориты. Содержание фосфора в пересчете на оксид фосфора варьирует от 35 (очень богатые) дом 5–10 % (очень бедные). Фосфорные руды нередко имеют большое количество примесей и подлежат обогащению.[2]
Фосфатное сырье перерабатывается на удобрение четырьмя основными способами:
- Измельчением в фосфоритную муку.
- Разложением фосфатов кислотами: серной, фосфорной, азотной.
- Электротермическим восстановлением фосфатов углеродом в присутствии диоксида кремния с извлечением элементарного фосфора и его последующей переработкой в фосфорную кислоту и ее соли.
- Термической обработкой фосфатов. В частности, щелочным разложением при сплавлении и спекании фосфатов с солями щелочноземельных и щелочных металлов или гидротермической переработкой в присутствии пара.[1]
Статья составлена с использованием следующих материалов:
Литературные источники:
1.Вильдфлуш И. Р., Цыганов А. Р., Лапа В. В., Персикова Т. Ф. Рациональное применение удобрений: Пособие. – Горки: Белорусская государственная сельскохозяйственная академия, 2002.– 324 с.
2.Минеев В.Г. Агрохимия: Учебник.– 2-е издание, переработанное и дополненное.– М.: Издательство МГУ, Издательство «КолосС», 2004.– 720 с., [16] л. ил.: ил. – (Классический университетский учебник).
3.Эвенчик С.Д., Бродский А.А. Технология фосфорных и комплексных удобрений, М.: Химия, 1987, – 464 с.
4.Эндрюс Ю.Б. Применение органических и минеральных удобрений (на разных почвах и под разные культуры). Перевод с английского Т.Л. Чебановой Под редакцией и предисловием академика ВАСХНИЛ проф. Н.С. Соколова. – М.: Издательство иностранной литературы, 1959 г. – 402с.
5.Ягодин Б.А., Жуков Ю.П., Кобзаренко В.И. Агрохимия / Под редакцией Б.А. Ягодина.– М.: Колос, 2002.– 584 с.: ил (Учебники и учебные пособия для студентов высших учебных заведений).
Изображения (переработаны):
6.7.8.Sugar, by Melissa Wiese, по лицензии CC BY
Свернуть Список всех источниковСдать анализ на фосфор неорганический
Метод определения Колориметрический с молибдатом аммония.
Исследуемый материал Сыворотка крови
Доступен выезд на дом
Онлайн-регистрацияНеорганический фосфор – один из основных анионов организма.
Синонимы: Анализ крови на фосфор; Неорганический фосфор в крови; Сывороточный фосфор; Сывороточный фосфат. Inorganic Phosphate; Phosphorus; Serum P; PO4; Phosphate.
Краткое описание определяемого вещества Фосфор неорганический
Фосфор в форме органических и неорганических соединений широко распространен в организме. Около 85% фосфора организма находится в костной ткани в виде солей кальция – гидроксиапатитов, остальная часть – преимущественно в мягких тканях. В тканях фосфор содержится большей частью внутри клеток в составе органических (преимущественно) и неорганических соединений. Фосфаты играют основную роль в образовании высокоэнергетических соединений – аденозинтрифосфорной кислоты и креатинфосфата, которые используются как источник энергии для поддержания многих физиологических функций (мышечное сокращение, работа нервных клеток, процессы мембранного транспорта и др.). Фосфаты входят в состав фосфолипидов клеточных мембран, фосфопротеинов, нуклеиновых кислот, никотинамиддинуклеотидфосфата (НАДФ), участвующего в работе многих ферментных систем. Таким образом, фосфор включен в промежуточный метаболизм белков, жиров, углеводов, в обмен кислорода, процессы клеточного роста и деления.
В лабораторной практике используют определение неорганического фосфора сыворотки крови. Концентрация фосфатов в плазме крови важна для поддержания необходимого уровня внутриклеточного фосфора и в качестве субстрата, используемого при минерализации костей. Фосфаты участвуют в механизмах экскреции ионов водорода с мочой и поддержании кислотно-основного состояния крови.
С какой целью определяют концентрацию Фосфора неорганического в сыворотке крови
Оценку уровня неорганического фосфора в сыворотке крови применяют в обследованиях при различных заболеваниях, включая болезни почек, костной ткани, паращитовидных желез.
От чего зависит уровень Фосфора неорганического в сыворотке крови
Концентрация фосфатов в крови зависит от реабсорбции их в канальцах почек и соотношения процессов синтеза и резорбции в костной ткани, в меньшей степени – от выхода фосфатов из клеток других тканей и процессов всасывания и выделения в желудочно-кишечном тракте. К основным регуляторам фосфорного обмена относят паратгормон, кальцитонин и витамин D.
Литература
Основная литература
- Божко Е. Е., Золотавина М. Л., Братова А. В. Изменения биохимических показателей при заболеваниях, связанных с гиперпаратиреозом и дефицитом витамина D //Исследование различных направлений современной науки. – 2018. – С. 23-25.
- Ву А. Г. Б. Клиническое руководство Тица по лабораторным тестам //Ред. А. Ву (пер. с англ. В. В. Меньшикова). – 4-е издание – М., Лабора. – 2013.
- Зайцева Ю. А. Фосфор. Его роль в жизни человека, химический состав и норма в крови //Перспективные научные исследования: опыт, проблемы и перспективы развития. – 2019. – С. 23-26.
- Меликян А. А., Меньков А. В. Послеоперационный гипопаратиреоз: прогнозирование, профилактика и лечение (обзор) //Современные технологии в медицине. – 2020. – Т. 12. – №. 2.
- Мокрышева Н. Г., Еремкина А. К., Ковалева Е. В. Хронический гипопаратиреоз у взрослых: клиническая картина, диагностика, лечение, динамический контроль //Ожирение и метаболизм. – 2018. – Т. 15. – №. 4.
- Dalili S. et al. The Association Between Hemoglobin HbA1c with Serum Inorganic Phosphate in Children with Type 1 Diabetes //Diabetes, Metabolic Syndrome and Obesity: Targets and Therapy. – 2020. – Т. 13. – С. 3405.
- Isakova T. et al. KDOQI US commentary on the 2017 KDIGO clinical practice guideline update for the diagnosis, evaluation, prevention, and treatment of chronic kidney disease–mineral and bone disorder (CKD-MBD) //American Journal of Kidney Diseases. – 2017. – Т. 70. – №. 6. – С. 737-751.
- Vorland C. J. et al. Effects of excessive dietary phosphorus intake on bone health //Current osteoporosis reports. – 2017. – Т. 15. – №. 5. – С. 473-482.
- Walling M. W. Effects of Iα, 25-Dihydroxyvitamin D3 on Active Intestinal Inorganic Phosphate Absorption //Vitamin D-Biochemical, Chemical and Clinical Aspects Related to Calcium Metabolism. – de Gruyter, 2020. – С. 321-330.
Российские фосфаты слились из США – Газета Коммерсантъ № 185 (6906) от 09.10.2020
Хотя США отложили решение в рамках расследования в отношении импорта фосфорных удобрений из России и Марокко, их стоимость выросла на треть, до рекордного уровня за последние десять лет. Дело в том, что на фоне расследования поставки почти прекратились, а североамериканская Mosaic не может покрыть растущий спрос. На других крупнейших рынках цены также постепенно восстанавливаются после падения в 2019 году, но столь же резкого роста эксперты не ожидают.
Стоимость основных фосфорных удобрений в США за последние три месяца увеличилась почти на треть, до $400 за тонну, и может продолжить рост, сообщили “Ъ” источники среди трейдеров. Эти данные подтверждают котировки Green Markets Index, согласно которым стоимость диаммоний и моноаммоний фосфатов (DAP и MAP) в третьем квартале 2020 года выросла на 29%, что является рекордом с 2010 года.
Основной причиной стал фактический уход с североамериканского рынка российских и марокканских поставщиков, после того как летом по требованию местной Mosaic в их отношении начала расследование Комиссия по международной торговле США.
В Mosaic, основном производителе фосфорных удобрений в стране, считают, что Россия и Марокко субсидируют производство фосфорных удобрений. Поэтому компания просила ввести компенсационные пошлины.
В начале августа в комиссии сообщили, что обнаружили «весомые свидетельства» материального урона из-за импорта в страну фосфорных удобрений из Марокко и РФ (занимали первое и второе места соответственно по объему поставок). Предполагалось, что предварительное решение США примут 21 сентября, но сроки были смещены на 23 ноября. Окончательного решения на рынке ожидают в марте 2021 года.
По данным Управления международной торговли, в прошлом году США получили из Марокко более 2 млн тонн фосфорных удобрений, из России — около 770 тыс. тонн, крупнейшие поставщики — «Фосагро» и «Еврохим».
В компаниях не комментируют ситуацию, но источник, знакомый с их позицией, пояснил, что химики не стали дожидаться пошлин и переориентировали объемы в Россию, Бразилию и Канаду.
Между тем перспективы расследования не до конца очевидны. По данным “Ъ”, ассоциации американских фермеров, такие как American Farm Bureau Federation, не раз обращались в комиссию с просьбой не вводить пошлины, опасаясь резкого роста цен на фосфорные удобрения (на них приходится более 3% затрат сельхозпроизводителей). Источники “Ъ” на химическом рынке подчеркивают, что поставщикам удобрений, которые нашли новые рынки сбыта, пошлины уже, по сути, не страшны.
Анастасия Егазарян из БКС отмечает, что резкий рост цен на фосфорные удобрения выглядит локальным для США. Заменить Россию и Марокко для страны, по мнению эксперта, может только Китай, чьи удобрения дороже. На других рынках, например в ЕС, стоимость фосфорных удобрений к концу года, по ее прогнозу, составит около $330 за тонну. Госпожа Егазарян отмечает, что на данный момент стоимость почти всех видов минудобрений восстанавливается после минимумов 2019 года, но существенного роста цен ждать не стоит. По мнению независимого эксперта Леонида Хазанова, дефицит фосфорных удобрений в США сохранится, так как в мире не так уж много их производителей, а Mosaic полностью со спросом не справится.
Ольга Мордюшенко
Анализ крови на неорганический фосфор
Показания к исследованию
Анализ крови на фосфор показан при заболеваниях: почек, костей, паращитовидных желез.
В крови и костной ткани элемент находится в виде фосфатов. Уровень неорганического фосфора связана с всасыванием фосфатов в почечных канальцах, образования и распада в костях. В них концентрируется порядка 85 процентов от общего количества фосфора.
Для клинической диагностики имеет значение соотношение в анализе крови кальция и неорганического фосфора.
Повышение или понижение уровня фосфора
Если фосфор в крови понижен, то это может свидетельствовать о таких заболеваниях, как анорексия, диабет или алкоголизм. Такой же эффект появляется при целиакии или болезни Крона, что приводит к хрупкости костей, постоянной усталости и потере аппетита, колебаниям массы тела, тревоге и снижению подвижности суставов. Но более распространенной проблемой является повышенный уровень фосфора в крови.
Повышение уровня фосфора вызывают заболевания почек или чрезмерное употребление его с пищей. Организму нужно соблюдать баланс фосфора и кальция в крови. Когда же уровень фосфатов повышается, могут начаться болезни костей – такие как остеопороз зубов или десен.
Высокий уровень фосфора в крови указывает на заболевания почек, недоедание, желудочно-кишечные расстройства, нехватку кальция и проблемы с костями.
Значения фосфора у детей и взрослых
Дети первых дней и месяцев жизни особо нуждаются в таких элементах, как фосфор и кальций, ведь при нарушении их обмена в костях формируются рахит, который в запущенных случаях трудно исправить.
У женщин во время беременности и в период лактации потребность в фосфоре возрастает. Сначала она обеспечивает своими запасами внутриутробное развитие ребенка (формирование костной системы), а затем с грудным молоком вводит в организм малыша достаточное количество фосфопротеинов, в частности, казеиногена, который является источником витамина D.
Таким образом, самый высокий уровень фосфора обнаруживается у детей первых месяцев жизни, затем он плавно снижается и устанавливается на более-менее стабильных значениях к возрасту совершеннолетия, чтобы поддерживать эти показатели до 60 лет:
Норма неорганического фосфора в крови:
Разница между фосфором и фосфатом
Что такое фосфор?
Фосфор (P) – многовалентный неметаллический химический элемент группы VA, № 15 Периодической системы. Его молярная масса 30,97. Известно двадцать три изотопа фосфора, но только один из них является стабильным.
Фосфор – элемент с высокой реакционной способностью. Реагирует с кислородом, галогенами, серой и многими металлами. Из-за его высокой реакционной способности фосфор не может быть найден как свободный элемент на Земле.
Атом фосфора содержит пять валентных электронов на внешнем слое. В соединениях с металлами и водородом фосфор проявляет степень окисления –3, а при взаимодействии с более электроотрицательными элементами, такими как кислород, фтор и т. Д., Степень окисления составляет +3 или +5.
Фосфор характеризуется аллотропией. Он образует несколько простых веществ, различающихся по структуре и свойствам. Наиболее распространены белый и красный фосфор.
Белый фосфор состоит из молекул P 4 .Это белое воскообразное вещество с желтым оттенком, светящееся в темноте. Белый фосфор не растворяется в воде, но растворяется в сероуглероде. Это ядовито. Он очень реактивен и может самовоспламеняться.
Красный фосфор имеет кристаллическую атомную решетку. Не растворяется в воде и сероуглероде. Он не ядовит и имеет более низкую активность по сравнению с белым фосфором.
Аллотропные модификации фосфора взаимопревращаемы.
Что такое фосфат?
Фосфат – это химическое производное фосфорной кислоты, содержащее фосфат-ион (PO 3 – 4 ).Ион фосфата может образовывать множество различных солей. Формально любая соль оксикислоты фосфора является фосфатом.
Ион фосфата – многоатомный ион с тетраэдрическим расположением атомов. Он состоит из одного атома фосфора, расположенного в центре и окруженного четырьмя атомами кислорода. Молярная масса фосфат-иона составляет 94,97 г / моль.
В зависимости от числа атомов фосфора фосфаты можно разделить на четыре основные группы: ортофосфаты, пирофосфаты, триполифосфаты и полифосфаты.Каждая из этих групп имеет свои специфические функциональные свойства.
Разница между фосфором и фосфатом
Определение
Фосфор: Фосфор – это многовалентный неметаллический химический элемент группы VA.
Фосфат: Фосфат представляет собой химическое производное фосфорной кислоты, содержащее фосфат-ион (PO 3 – 4 ). Формально любая соль оксикислоты фосфора является фосфатом.
Молярная масса
Фосфор: Молярная масса фосфора составляет 30,97 г / моль.
Фосфат: Молярная масса иона фосфата составляет 94,97 г / моль.
Химическая формула
Фосфор: Символ фосфора – P.
Фосфат: Химическая формула фосфат-иона PO 4.
Конструкция
Фосфор: Фосфор образует несколько простых веществ, наиболее широко распространены белый фосфор, состоящий из молекул P 4 , и красный фосфор, который имеет кристаллическую атомную решетку.
Фосфат: Ион фосфата представляет собой многоатомный ион с тетраэдрическим расположением атомов. Он состоит из одного атома фосфора, расположенного в центре и окруженного четырьмя атомами кислорода.
Степень окисления
Фосфор: В соединениях с металлами и водородом фосфор проявляет степень окисления –3, а при взаимодействии с более электроотрицательными элементами, такими как кислород, фтор и т. Д., Степень окисления составляет +3 или +5.
Фосфат: Фосфат имеет степень окисления –3.
Формы / типы
Фосфор: Фосфор характеризуется аллотропией и образует несколько простых веществ, различающихся по структуре и свойствам. Наиболее распространены белый и красный фосфор.
Фосфат: В зависимости от количества атомов фосфора фосфаты бывают ортофосфатами, пирофосфатами, триполифосфатами и полифосфатами.
Phosphorus Vs. Фосфат: сравнительная таблица
Краткое изложение Phosphorus Vs.Фосфат:
- Фосфор – многовалентный неметаллический химический элемент группы VA.
- Фосфат – это химическое производное фосфорной кислоты, содержащее фосфат-ион (PO 3 – 4 ). Формально любая соль оксикислоты фосфора является фосфатом.
- Молярная масса фосфора составляет 30,97 г / моль. Молярная масса фосфат-иона составляет 94,97 г / моль.
- Символ фосфора – P. Химическая формула фосфат-иона PO 4.
- Белый фосфор состоит из молекул P 4 , красный фосфор имеет кристаллическую атомную решетку. Фосфат-ион – это многоатомный ион с тетраэдрическим расположением атомов, состоящий из одного атома фосфора, расположенного в центре и окруженного четырьмя атомами кислорода.
- Фосфор имеет степень окисления –3, +3 или +5. Фосфат имеет степень окисления –3.
- Фосфор образует несколько простых веществ, различающихся по структуре и свойствам, наиболее распространены белый и красный фосфор.В зависимости от числа атомов фосфора фосфаты бывают ортофосфатами, пирофосфатами, триполифосфатами и полифосфатами.
Эксперт-эколог, доктор ботаники, Институт исследований леса Болгарской академии наук.
Мариам имеет степень магистра экологии и доктора ботаники.
В настоящее время она работает в Научно-исследовательском институте леса Болгарской академии наук.
Мариам имеет более 10 лет профессионального опыта в области научных исследований и консультирования по вопросам окружающей среды.Она работала в некоммерческой, коммерческой и академической среде и консультировала бизнес-клиентов и компетентные органы.
Основные профессиональные интересы:
Научные исследования;
Написание веб-контента;
Консультации по охране окружающей среды.
: Если вам понравилась эта статья или наш сайт. Пожалуйста, расскажите об этом. Поделитесь им с друзьями / семьей.
Цит.
APA 7
Божилова, Д.(2019, 5 июля). Разница между фосфором и фосфатом. Разница между похожими терминами и объектами. http://www.differencebetween.net/science/difference-between-phosphorus-and-phosphate/.
ОМС 8
Божилова, д-р Мариам. «Разница между фосфором и фосфатом». Разница между похожими терминами и объектами, 5 июля 2019 г., http://www.differencebetween.net/science/difference-between-phosphorus-and-phosphate/.
Фосфат vs.Фосфор – В чем разница?
Фосфат
Фосфат – это химическое производное фосфорной кислоты. Ион фосфата (PO3-4) – неорганическое химическое соединение, сопряженное основание, которое может образовывать множество различных солей. В органической химии фосфат или органофосфат представляет собой сложный эфир фосфорной кислоты. Из различных фосфорных кислот и фосфатов органические фосфаты играют важную роль в биохимии и биогеохимии (и, следовательно, в экологии), а неорганические фосфаты добываются для получения фосфора для использования в сельском хозяйстве и промышленности.При повышенных температурах в твердом состоянии фосфаты могут конденсироваться с образованием пирофосфатов.
В биологии добавление фосфатов к белкам в клетках и их удаление из них играют ключевую роль в регуляции метаболических процессов. Называемые соответственно фосфорилированием и дефосфорилированием, они являются важными способами хранения и высвобождения энергии в живых системах.
фосфор
Фосфор – химический элемент с символом P и атомным номером 15. Элементный фосфор существует в двух основных формах: белый фосфор и красный фосфор, но из-за его высокой реакционной способности фосфор никогда не встречается на Земле как свободный элемент.Его концентрация в земной коре составляет около одного грамма на килограмм (сравните с медью около 0,06 грамма). За некоторыми исключениями, минералы, содержащие фосфор, находятся в максимально окисленном состоянии как неорганические фосфатные породы.
Элементный фосфор был впервые выделен (как белый фосфор) в 1669 году и излучал слабое свечение при воздействии кислорода – отсюда и название, взятое из греческой мифологии, Φωσφςρος, что означает «светоносец» (лат. Люцифер), что означает «Утро». Звезда », планета Венера.Термин «фосфоресценция», означающий свечение после освещения, происходит от этого свойства фосфора, хотя с тех пор это слово использовалось для другого физического процесса, который вызывает свечение. Свечение фосфора вызвано окислением белого (но не красного) фосфора – процесс, который теперь называется хемилюминесценцией. Вместе с азотом, мышьяком, сурьмой и висмутом фосфор классифицируется как пниктоген.
Фосфор необходим для жизни. Фосфаты (соединения, содержащие фосфат-ион, PO43-) являются компонентом ДНК, РНК, АТФ и фосфолипидов.Элементарный фосфор был впервые выделен из мочи человека, а костная зола была важным ранним источником фосфата. Фосфатные рудники содержат окаменелости, потому что фосфат присутствует в окаменелых отложениях останков и экскрементов животных. Низкий уровень фосфатов является важным ограничением роста в некоторых водных системах. Подавляющее большинство добываемых соединений фосфора используется в качестве удобрений. Фосфат необходим для замены фосфора, который растения удаляют из почвы, и его годовая потребность растет почти в два раза быстрее, чем рост населения.Другие применения включают фосфорорганические соединения в моющих средствах, пестицидах и нервно-паралитических веществах.
Фосфат в анализе крови | Мичиган Медицина
Обзор теста
Фосфатный тест измеряет количество фосфата в образце крови. Фосфат – это заряженная частица (ион), содержащая минеральный фосфор. Организму нужен фосфор, чтобы строить и восстанавливать кости и зубы, помогать нервным окончаниям и заставлять мышцы сокращаться. Больше всего (около 85%) фосфора, содержащегося в фосфате, содержится в костях.Остальная его часть хранится в тканях по всему телу.
Почки помогают контролировать количество фосфатов в крови. Дополнительный фосфат фильтруется почками и выводится из организма с мочой. Высокий уровень фосфата в крови обычно вызван проблемами с почками.
Количество фосфатов в крови влияет на уровень кальция в крови. Кальций и фосфат в организме реагируют противоположным образом: когда уровень кальция в крови повышается, уровень фосфата падает.Гормон, называемый паратиреоидным гормоном (ПТГ), регулирует уровень кальция и фосфора в крови. При измерении уровня фосфора одновременно измеряется уровень витамина D, а иногда и уровень ПТГ. Витамин D необходим вашему организму, чтобы усваивать фосфаты.
Связь между кальцием и фосфатом может быть нарушена некоторыми заболеваниями или инфекциями. По этой причине уровни фосфата и кальция обычно измеряются одновременно.
Почему это сделано
Этот тест может проводиться для проверки уровня фосфатов, если у вас заболевание почек или костей.Это помогает найти проблемы с определенными железами, такими как паращитовидные железы. Тест также используется, чтобы найти причину аномального уровня витамина D.
Как подготовить
Сообщите своему врачу ВСЕ лекарства, витамины, пищевые добавки и лечебные травы, которые вы принимаете. Некоторые могут повлиять на результаты теста. Ваш врач скажет вам, следует ли вам прекратить принимать какие-либо из них до обследования и как скоро это сделать.
Как это делается
Анализ крови
Медицинский работник использует иглу для взятия пробы крови, обычно из руки.
Пятка
Пяточная палочка используется для взятия пробы крови у ребенка. Пятка малыша протыкается, и берется несколько капель крови. У ребенка может быть крошечный синяк на пятке
Сколько времени длится тест
Этот тест займет несколько минут.
Часы
Каково это
Анализ крови
При взятии пробы крови игла может вообще ничего не чувствовать.Или вы можете почувствовать укол или ущипнуть.
Пятка
Кратковременная боль, подобная укусу или укусу, обычно ощущается при прокалывании кожи ланцетом. Ребенок может чувствовать небольшой дискомфорт при проколе кожи.
Риски
Анализ крови
В этом тесте очень малая вероятность возникновения проблемы. При заборе крови на месте может образоваться небольшой синяк.
Пятка
Риск проблемы из-за прикосновения к пятке очень мал.У ребенка на месте прокола может образоваться небольшой синяк.
Результаты
Уровень фосфатов у детей обычно выше, чем у взрослых. Это из-за активного роста костей у детей.
Результаты обычно доступны в течение 1-2 часов.
Нормальный
В каждой лаборатории свой диапазон нормальных значений. В вашем лабораторном отчете должен быть указан диапазон, который ваша лаборатория использует для каждого теста. Нормальный диапазон – это просто ориентир.Ваш врач также рассмотрит ваши результаты в зависимости от вашего возраста, состояния здоровья и других факторов. Значение, выходящее за пределы нормального диапазона, может быть для вас нормальным.
Высокие значения
Высокий уровень фосфатов может быть вызван:
Низкие значения
Низкий уровень фосфатов может быть вызван:
- Гиперпаратиреоз, некоторые заболевания костей (например, остеомаляция), недостаток витамина D или некоторые заболевания почек или печени.
- Тяжелое недоедание или голодание.
- Состояние, такое как стояк, которое препятствует правильному усвоению питательных веществ кишечником.
- Расстройство, связанное с употреблением алкоголя.
- Высокий уровень кальция.
- Некоторые виды опухолей.
Кредиты
Текущий по состоянию на: 31 марта 2020 г.
Автор: Healthwise Staff
Медицинский обзор:
E.Грегори Томпсон, врач-терапевт
Кэтлин Ромито, доктор медицины, семейная медицина
Алан К. Далкин, врач-эндокринолог
По состоянию на 31 марта 2020 г.
Автор: Здоровый персонал
Медицинское обозрение: E. Грегори Томпсон, врач-терапевт и Кэтлин Ромито, доктор медицины, семейная медицина и Алан К. Далкин, доктор медицины, эндокринология
Purpose, High vs.Низкий и нормальный уровни
Фосфатный тест измеряет количество фосфатов в вашей крови. Если это звучит слишком просто, ждите небольшого поворота.
Фосфат – это то, что вы получите, если соединить минеральный фосфор с кислородом. Когда вы едите определенные продукты, такие как бобы, орехи, хлопья, молоко, яйца, говядину, курицу и рыбу, фосфор попадает в ваш кишечник. Когда он встречается с кислородом, он становится фосфатом.
Большинство фосфатов объединяются с кальцием, чтобы строить и восстанавливать кости и зубы.Некоторые поддерживают ваши мышцы и нервы.
Вот где возникают сложности: когда дело доходит до тестирования, фосфор иногда называют фосфатом, и наоборот. Пусть вас не сбивают с толку все эти слова «ф-ф».
Зачем мне нужен тест?
Хотя фосфат всасывается в кишечнике, он фильтруется и выводится через почки.
Аномальный уровень фосфатов с такими симптомами, как проблемы с костями, усталость и слабость, может указывать на заболевание почек. Ваш врач может также попросить вас пройти тест на фосфаты, если они подозревают:
Поскольку фосфаты так тесно взаимодействуют с кальцием, врачи также используют тест, чтобы определить, правильно ли ваше тело получает и использует кальций.Проблемы, связанные с кальцием, могут быть признаком низкого уровня витамина D или могут включать:
- Проблемы с костями
- Чувство сильной усталости
- Слабость мышц
- Спазмы
Как мне к этому подготовиться?
Ваш врач даст вам инструкции; внимательно следите за ними.
Вас могут попросить ничего не есть с полуночи перед тестом до его окончания.
Убедитесь, что ваш врач знает обо всем, что вы принимаете, включая лекарства, отпускаемые по рецепту и без рецепта, травяные добавки, витамины, а также рекреационные или запрещенные препараты.
Что происходит во время теста?
После очистки кожи на части руки техник вставит иглу в одну из ваших вен. Они могут обернуть эластичную ленту вокруг верхней части руки, чтобы было легче найти вену.
После того, как в пробирку поступит достаточное количество крови, техник снимет повязку, вытащит иглу и остановит кровотечение ватным тампоном или повязкой. ВНИМАНИЕ !!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!! На пробирку с кровью наклеят этикетку, и ее отправят в лабораторию.
При любом анализе крови вы можете почувствовать:
- Боль при введении иглы
- Головокружение
- Болезненность или синяк
- Кровотечение
Что может повлиять на результаты моих анализов?
Диализ может повлиять на уровень фосфатов, как и некоторые лекарства.Некоторые продукты, которые вы едите и пьете, также могут иметь эффект, поэтому перед тестом проконсультируйтесь с врачом, стоит ли избегать их:
- Фасоль (разных видов)
- Пиво
- Сыр
- Шоколад
- Кола
- Рыба
Что означают результаты моих тестов?
Когда результаты слишком высокие или слишком низкие, это признак того, что что-то не так.
Если у вас низкий уровень фосфатов, это может быть признаком:
Высокий уровень фосфатов может указывать на:
Какие еще анализы я могу пройти?
Ваш врач может назначить вам другие анализы вместе с анализом крови на фосфаты, чтобы помочь сузить диагноз.Они могут включать тесты на:
- Кальций
- Витамин D
- ПТГ (гормон, вырабатываемый паращитовидной железой)
Ортофосфат – обзор | Темы ScienceDirect
Введение
Трифилит – довольно дефицитный ортофосфатный минерал, который в основном встречается в фосфатных пегматитах и пегматитовых дайках. Его формула – Li (Mn, Fe) PO 4 , и он отличается от другого минерала, литиофилита, тем, что он богат железом вместо марганца.Структуры двух минералов одинаковы и образуют твердый раствор, называемый серией трифилита, изоморфный оливину. Следовательно, любые различия в физических свойствах между ними будут связаны с процентным содержанием железа / марганца. Эти различия лучше всего подтверждаются сравнением физических свойств двух элементов на противоположных краях семейства трифилитов, а именно фосфата лития-железа (LiFePO 4 ) и часто связанного материала фосфата лития-марганца (LiMnPO 4 ), который , в отличие от трифилита и литиофилита, это в основном искусственная керамика.Они принадлежат к богатому семейству оливинов типа ортосиликата магния (Mg 2 SiO 4 ), имеющего общую формулу B 2 AX 4 .
Трифилит легко превращается в другие фосфатные минералы, и геологи проявляют к нему большое уважение, делая возможными другие фосфатные минералы. Действительно, фосфат лития-железа – это первичный минерал, который сейчас встречается редко. Железо является двухвалентным в этом материале, а это означает, что оно образовалось в то время, когда кислород еще не существовал в атмосфере Земли.С появлением кислорода эти минералы Fe 2+ окислились. Однако это свойство означает, что трифилит не очень стабилен и что трудно получить образцы хорошего качества. Эта особенность, которая радует геологов, является, таким образом, только плохой новостью для физиков и химиков, которым приходится бороться, чтобы избежать воздействия кислорода во время подготовки образцов, чтобы предотвратить образование вторичных фаз, в которых железо принимает то, что ему нравится. большинство, а именно состояние трехвалентного заряда.
Несмотря на этот недостаток, большое внимание было сосредоточено на серии трифилита, поскольку группа Гуденафа доказала, что фосфо-оливин-литий-фосфат железа является потенциальным материалом положительного электрода для использования в литиевых перезаряжаемых батареях. В качестве катодного элемента он обеспечивает постоянное напряжение и высокую емкость (∼170 мА ч г -1 ) при умеренных плотностях тока. Кроме того, это недорогой, безопасный и нетоксичный материал – три определяющих преимущества по сравнению с материалами на основе оксида кобальта для крупномасштабных применений, таких как гибридные электромобили (HEV).Вся серия трифилита LiFe 1– x Mn x PO 4 была исследована по той же причине, но введение марганца создает дополнительные проблемы, которые обсуждались в другом месте, и мы ограничимся Настоящая статья посвящена фосфату лития-железа.
Объемная электронная проводимость фосфата лития-железа довольно низкая, что может привести к потере емкости во время высокоскоростного разряда. Для увеличения электронной проводимости при производстве катодов литий-ионных батарей обычной практикой является добавление углерода либо путем использования углеродных добавок к матрице фосфата лития-железа, либо путем покрытия поверхности частиц фосфата лития-железа тонкими слоями углерода.Углерод, высвобождающийся из сахарозы, добавленной к предшественникам фосфата лития-железа в процессе синтеза методом распылительного пиролиза, увеличивает электронную проводимость на 7 порядков. Таким образом, добавление углерода дает преимущество в сочетании гораздо лучшей электронной проводимости и высокой емкости. В частности, для фосфата лития-железа, покрытого ~ 1 мас.% Углерода, была обнаружена емкость около 160 мА · ч · г -1 .
N. Равет и его коллеги сообщили о двух способах нанесения углеродного покрытия: смешивание порошка фосфата лития-железа с раствором сахара и нагревание смеси при 700 ° C или синтез фосфата лития-железа с добавлением некоторых органических материалов перед нагреванием.Хотя способ добавления углерода еще не полностью оптимизирован, улучшение будет включать глубокое исследование синтеза и влияния процесса осаждения углерода на фосфат лития-железа. Известно, что электрохимические свойства фосфата лития-железа зависят от способа получения и структурных свойств. Это может быть преимуществом для потенциальных приложений, поскольку позволяет оптимизировать материал, если мы можем соотнести способ приготовления со структурными и физическими свойствами.Вот почему мы впервые исследовали эту корреляцию в фосфате лития-железа, выращенном тремя разными способами.
Целью данной статьи является исследование физико-химических свойств оптимизированных литий-железо-фосфатных электродных материалов. Один из подходов к пониманию структурных и электронных свойств электродных материалов включает систематическое исследование с помощью комбинации методов, включая структурные, магнитные и спектроскопические измерения. Кроме того, можно использовать высокую чувствительность некоторых аналитических инструментов для обнаружения паразитных примесей, которые могут расти во время синтеза твердых фаз.Эти принципы были полностью использованы для оптимизации соединений фосфата лития и железа. Из-за важности примесей / дефектов с научной точки зрения, а также для приложений, им посвящен отдельный раздел. Исследуются образцы фосфата лития-железа как безуглеродистого, так и покрытого углеродом, чтобы исследовать влияние углерода на структурные свойства. Эксперименты включают в себя обычные инструменты, такие как дифракция рентгеновских лучей (XRD), инфракрасная спектроскопия с преобразованием Фурье (FTIR) и спектроскопия комбинационного рассеяния (RS).Однако эти методы не позволяют обнаруживать примеси или кластеры нанометрового размера с концентрацией ниже 1%. Затем мы завершаем анализ магнитными измерениями: кривыми намагничивания и электронно-спиновым резонансом (ЭПР), поскольку они являются мощными инструментами для характеристики сильно ферримагнитных наночастиц γ-Fe 2 O 3 (как по размеру, так и по концентрации) даже при концентрациях столь же мал, как ppm или ферромагнитный фосфид железа (Fe 2 P). Они также являются мощными инструментами для обнаружения локальных дефектов, таких как вакансии лития, несмотря на то, что литий не является магнитным, потому что нескомпенсированный заряд, связанный с вакансией Li + , генерирует ион Fe 3+ поблизости и d- «дырка» поляризует спин-поляризацию других ионов Fe 2+ , находящихся поблизости, с образованием магнитных поляронов.Тем не менее, этого набора экспериментов недостаточно для характеристики углеродсодержащих соединений. Во-первых, они немагнитны. Во-вторых, чувствительность FTIR-спектроскопии, которая является исследованием объемных свойств, недостаточно чувствительна для обнаружения углерода. Поэтому мы добавили исследование рамановских спектров. Поскольку глубина проникновения света внутрь частиц фосфата лития-железа в таких экспериментах очень мала, эти эксперименты являются зондом первых слоев на поверхности этих частиц и позволяют обнаруживать углеродное покрытие.Они также свидетельствуют о том, что углерод не проникает внутрь частиц, а на самом деле застревает на их поверхности.
Статья организована следующим образом. Первый раздел посвящен процессу синтеза и экспериментальной установке, используемой для определения характеристик образцов. Затем раздел посвящен изучению примесей, способных отравить материал. Следующий раздел посвящен анализу «объемных» свойств, то есть свойств частиц типичного размера 100 нм или больше.Однако в недавнем прошлом сообществом были предприняты усилия по уменьшению размера частиц, и в этом случае поверхностные эффекты становятся все более важными. Следующий раздел посвящен поверхностным эффектам. Наконец, мы сообщаем об электрохимических свойствах, полученных на нескольких образцах фосфата лития-железа, с особым вниманием к новому поколению фосфо-оливиновых материалов, используемых в литиевых элементах, способных работать при 60 ° C. Электрохимические ячейки, включающие различные отрицательные электроды, то есть фольгу металлического лития, графит и шпинель титаната лития, исследуются, и представлены долговременные циклические характеристики.
Фосфорные удобрения | UMN Extension
Производство большинства коммерческих фосфатных удобрений начинается с производства фосфорной кислоты.
Обобщенная диаграмма на Рисунке 1 показывает этапы производства различных фосфорных удобрений. Фосфорная кислота производится сухим или мокрым способом.
Рисунок 1: Процесс производства различных фосфорных удобрений.Сухой и мокрый процесс
В процессе сухого процесса электрическая печь обрабатывает фосфат.Эта обработка дает очень чистую и более дорогую фосфорную кислоту, которую часто называют белой или печной кислотой, которая в основном используется в пищевой и химической промышленности.
Удобрения, в которых в качестве источника фосфора используется белая фосфорная кислота, как правило, более дороги из-за дорогостоящего процесса обработки.
Мокрый процесс включает в себя обработку каменного фосфата фосфорной кислотой, производящей кислоту, также называемой зеленой или черной кислотой, и гипсом, который удаляется как побочный продукт. Примеси, придающие кислоте цвет, не были проблемой при производстве сухих удобрений.
Ортофосфорная кислота
В процессе влажной и сухой обработки образуется ортофосфорная кислота – фосфатная форма, усваиваемая растениями.
Фосфорная кислота, полученная мокрым или сухим способом, часто нагревается, удаляя воду и производя суперфосфорную кислоту. Концентрация фосфата в суперфосфорной кислоте обычно колеблется от 72 до 76 процентов.
P в этой кислоте присутствует как ортофосфат, так и полифосфат. Полифосфаты состоят из ряда ортофосфатов, которые химически соединены вместе.При контакте с почвой полифосфаты снова превращаются в ортофосфаты.
Добавление аммиака
Аммиак может быть добавлен к суперфосфорной кислоте для создания жидких или сухих материалов, содержащих как азот (N), так и P. Жидкость 10-34-0 является наиболее распространенным продуктом.
10-34-0 можно смешивать с мелкоизмельченным калием (0-0-62), водой и раствором аммиачной селитры (28-0-0) с образованием 7-21-7 и родственных ему сортов. P в этих продуктах присутствует как в ортофосфатной, так и в полифосфатной форме.
Когда аммиак добавляется к фосфорной кислоте, которая не нагревается, образуется моноаммонийфосфат (11-52-0) или диаммонийфосфат (18-46-0), в зависимости от соотношения в смеси. P, присутствующий в этих двух удобрениях, находится в ортофосфатной форме.
Стоимость и результат
Стоимость преобразования каменного фосфора в отдельные фосфатные удобрения зависит от процесса. Что еще более важно, процессы не влияют на доступность фосфора для растений.
Фосфор – Информация об элементе, свойства и применение
Расшифровка:
Химия в ее элементе: фосфор
(Promo)
Вы слушаете Химию в ее элементе, представленную вам журналом Chemistry World , журналом Королевского химического общества.
(Конец промо)
Крис Смит
Здравствуйте, на этой неделе удобрения, зажигательные бомбы, фосистая челюсть и пищевые добавки.Какая связь? Вот Нина Нотман.
Нина Нотман
Фосфор – неметалл, который находится чуть ниже азота в группе 15 периодической таблицы. Этот элемент существует в нескольких формах, из которых наиболее известны белый и красный.
Белый фосфор определенно более захватывающий из двух. Поскольку он светится в темноте, опасно воспламеняется в воздухе при температуре выше 30 градусов и является смертельным ядом. Однако красный фосфор не обладает ни одним из этих удивительных свойств.
Итак, с чего все началось? Фосфор был впервые произведен Хеннигом Брандтом в Гамбурге в Германии в 1669 году. Когда он испарил мочу и нагрел остаток, пока он не стал докрасна. Отлетел светящийся пар фосфора, и он сконденсировал его под водой. И на протяжении более 100 лет большая часть фосфора производилась именно таким способом. Так было до тех пор, пока люди не поняли, что кость – отличный источник фосфора. Кость можно растворить в серной кислоте с образованием фосфорной кислоты, которую затем нагревают с древесным углем для образования белого фосфора.
Белый фосфор нашел множество весьма неприятных применений в войне. Он использовался в 20 годах в трассирующих пулях, зажигательных бомбах и дымовых гранатах. Разбрасывание фосфорных зажигательных бомб над городами во время Второй мировой войны привело к гибели людей и разрушениям. В июле 1943 года Гамбург подвергся нескольким авианалётам, в ходе которых на обширные районы города было сброшено 25000 фосфорных бомб. Это довольно иронично, учитывая, где впервые был произведен фосфор.
Другой группой боевых агентов на основе фосфора являются нервно-паралитические газы, такие как зарин.Зарин – это фторированный фосфонат, который Ирак использовал против Ирана с начала до середины 1980-х годов. А также был выпущен в токийском метро в 1995 году, в результате чего погибли 12 человек и пострадали почти тысяча человек.
Белый фосфор нашел также множество других применений. Одним из них были фосфорные спички, которые впервые были проданы в Стоктон-он-Тис в Великобритании в 1827 году. Это создало целую новую индустрию дешевых фонарей – но по ужасной цене. Вдыхание паров фосфора привело к фосфорной болезни челюсти, которая медленно разъедала челюстную кость.Это заболевание особенно поражало девушек, готовивших фосфорные спички. Таким образом, они были в конечном итоге запрещены в начале 1900-х годов и были заменены современными спичками, в которых использовался сульфид фосфора или красный фосфор.
Сегодня фосфор нашел применение не только в спичках, но и в освещении. Фосфид магния является основой самовоспламеняющихся сигнальных ракет, используемых в море. Когда он вступает в реакцию с водой, он образует самовоспламеняющийся газ, дифосфин, который вызывает зажигание факела.
Сверхчистый фосфор также используется для изготовления светодиодов. Эти светодиоды содержат фосфиды металлов, такие как галлий и индий.
В естественном мире элементарная форма фосфора никогда не встречается. Он рассматривается только как фосфат, а фосфат необходим для жизни по многим причинам. Он является частью ДНК, а также составляет огромную часть зубной эмали и костей в форме фосфата кальция. Также важны органофосфаты, такие как энергетическая молекула АТФ и фосфолипиды клеточных мембран.
Нормальная диета обеспечивает наш организм необходимыми фосфатами. С тунцом, курицей, яйцами и сыром много. И даже кола дает нам немного фосфорной кислоты.
Сегодня большая часть нашего фосфора поступает из фосфоритной руды, которая добывается во всем мире, а затем превращается в фосфорную кислоту. Ежегодно производится пятьдесят миллионов тонн, и он имеет множество применений. Из него делают удобрения, корма для животных, средства для удаления ржавчины, антикоррозийные средства и даже таблетки для посудомоечной машины.
Некоторая фосфоритная руда также нагревается с помощью кокса и песка в электрической печи с образованием белого фосфора, который затем превращается в треххлористый фосфор и фосфористую кислоту. И именно из них производятся антипирены, инсектициды и средства от сорняков. Немного также превращается в сульфиды фосфора, которые используются в качестве присадок к маслам для уменьшения износа двигателя.
Фосфат также важен для окружающей среды. Он естественным образом перемещается из почвы в реки, океаны и донные отложения.Здесь он накапливается, пока не будет перемещен геологическим поднятием на сушу, так что круг может начаться снова. Во время своего путешествия фосфат проходит через множество растений, микробов и животных различных экосистем.
Однако слишком много фосфатов может нанести вред природным водам, потому что это способствует процветанию нежелательных видов, таких как водоросли. Затем они вытесняют другие формы желанной жизни. В настоящее время существует юридическое требование по удалению фосфатов из сточных вод во многих частях мира, и в будущем он может быть переработан в качестве устойчивого ресурса, чтобы однажды фосфат, который мы смываем в раковины и туалеты, мог бы снова появиться в наших домах в других обличьях. например, в таблетках для посудомоечной машины и, возможно, даже в нашей еде и коле.
Крис Смит
Нина Нотман с рассказом о Фосфоре, элементе, извлеченном из золотого потока, также известном как моча. В следующий раз Андреа Селла присоединится к нам с взрывоопасной историей элемента номер 53.
Андреа Селла
В 1811 году молодой французский химик Бернар Куртуа, работавший в Париже, наткнулся на новый элемент. Фирма его семьи производила селитру, необходимую для производства пороха для наполеоновских войн. В своем производстве они использовали древесную золу, и нехватка древесины во время войны вынудила их сжигать морские водоросли.Добавив к золе концентрированную серную кислоту, Куртуа получил удивительно пурпурный пар, который кристаллизовался на стенках контейнера. Удивленный этим открытием, он запаковал сероватые кристаллы в бутылки и отправил их одному из ведущих химиков своего времени Жозефу Ги-Люссаку, который подтвердил, что это новый элемент, и назвал его йодом – йод – в честь греческого слова, обозначающего пурпурный.
Крис Смит
И вы можете услышать больше о том, как йод взорвался на мировой арене на следующей неделе “Химия в своем элементе”.



 Хотя подъем временный (на 5-6 часов), этот фактор должен учитываться при невозможности объяснить причину повышения концентрации фосфора ничем другим.
Хотя подъем временный (на 5-6 часов), этот фактор должен учитываться при невозможности объяснить причину повышения концентрации фосфора ничем другим. Свободная кислота в составе удобрения не превышает 2,5–5 %. Положительно влияет на рост и развитие всех сельскохозяйственных культур.[1]
Свободная кислота в составе удобрения не превышает 2,5–5 %. Положительно влияет на рост и развитие всех сельскохозяйственных культур.[1] Растворим в лимоннокислом аммонии и хорошо усваивается растениями. Применяется для основного внесения.[5] Используется для добавки в корма.[5]
Растворим в лимоннокислом аммонии и хорошо усваивается растениями. Применяется для основного внесения.[5] Используется для добавки в корма.[5]