| L60 | Болезни ногтей |
| Исключено: | |
| булавовидные ногти (R68.3) | |
| онихия и паронихия (L03.0) | |
| L60.0 Вросший ноготь | |
| L60.1 Онихолиз | |
| L60.2 Онихогрифоз | |
| L60.3 Дистрофия ногтя | |
| L60.4 Линии Бо | |
| L60.5 Синдром желтого ногтя | |
| L60.8 Другие болезни ногтей | |
| L60.9 Болезнь ногтя неуточненная | |
| L62* | Изменения ногтей при болезнях, классифицированных в других рубриках |
L62. 0* Булавовидный ноготь при пахидермопериостозе (M89.4+) 0* Булавовидный ноготь при пахидермопериостозе (M89.4+) | |
| L62.8* Изменения ногтей при других болезнях, классифицированных в других рубриках | |
| L63 | Гнездная алопеция |
| L63.0 Алопеция тотальная | |
| L63.1 Алопеция универсальная | |
| L63.2 Гнездная плешивость (лентовидная форма) | |
| L63.8 Другая гнездная алопеция | |
| L63.9 Гнездная алопеция неуточненная | |
| L64 | Андрогенная алопеция |
| Включено: мужской тип плешивости | |
| L64.0 Андрогенная алопеция, вызванная приемом лекарственных средств | |
При необходимости идентифицировать лекарственное средство используют дополнительный код внешних причин (класс XX). | |
| L64.8 Другая андрогенная алопеция | |
| L64.9 Андрогенная алопеция неуточненная | |
| L65 | Другая нерубцующая потеря волос |
| При необходимости идентифицировать лекарственное средство, вызвавшее поражение, используют дополнительный код внешних причин (класс XX). | |
| Исключено: трихотилломания (F63.3) | |
| L65.0 Телогенное выпадение волос | |
| L65.1 Анагенное выпадение волос | |
| L65.2 Алопеция муцинозная | |
| L65.8 Другая уточненная нерубцующая потеря волос | |
| L65.9 Нерубцующая потеря волос неуточненная | |
| L66 | Рубцующая алопеция |
L66. 0 Алопеция пятнистая рубцующая 0 Алопеция пятнистая рубцующая | |
| L66.1 Лишай плоский волосяной | |
| L66.2 Фолликулит, приводящий к облысению | |
| L66.3 Перифолликулит головы абсцедирующий | |
| L66.4 Фолликулит сетчатый рубцующий эритематозный | |
| L66.8 Другие рубцующие алопеции | |
| L66.9 Рубцующая алопеция неуточненная | |
| L67 | Аномалии цвета волос и волосяного стержня |
| Исключено: | |
| волосы бусовидные (Q84.1) | |
| телогенное выпадение волос (L65.0) | |
| узловатые волосы (Q84.1) | |
| L67.0 Трихорексис узловатый | |
L67. 1 Изменения окраски волос 1 Изменения окраски волос | |
| L67.8 Другие аномалии цвета волос и волосяного стержня | |
| L67.9 Аномалия цвета волос и волосяного стержня неуточненная | |
| L68 | Гипертрихоз |
| Включено: чрезмерная волосатость | |
| Исключено: | |
| врожденный гипертрихоз (Q84.2) | |
| устойчивые пушковые волосы (Q84.2) | |
| L68.0 Гирсутизм | |
| При необходимости идентифицировать лекарственное средство, вызвавшее нарушение, используют дополнительный код внешних причин (класс XX). | |
| L68.1 Гипертрихоз пушковыми волосами приобретенный | |
При необходимости идентифицировать лекарственное средство, вызвавшее нарушение, используют дополнительный код внешних причин (класс XX).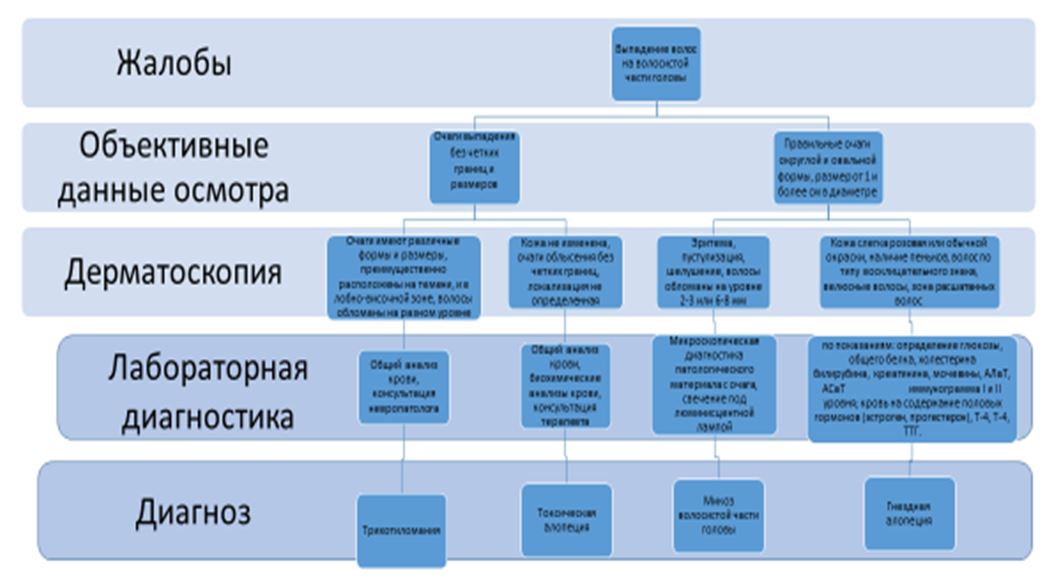 | |
| L68.2 Локализованный гипертрихоз | |
| L68.3 Политрихия | |
| L68.8 Другой гипертрихоз | |
| L68.9 Гипертрихоз неуточненный | |
| L70 | Угри |
| Исключено: келоидные угри (L73.0) | |
| L70.0 Угри обыкновенные | |
| L70.1 Угри шаровидные | |
| L70.2 Угри осповидные | |
| L70.3 Угри тропические | |
| L70.4 Детские угри | |
| L70.5 Acne excoriee des jeunes filles | |
| L70.8 Другие угри | |
| L70.9 Угри неуточненные | |
| L71 | Розацеа |
L71. 0 Периоральный дерматит 0 Периоральный дерматит | |
| При необходимости идентифицировать лекарственный препарат, вызвавший поражение, используют дополнительный код внешних причин (класс XX). | |
| L71.1 Ринофима | |
| L71.8 Другой вид розацеа | |
| L71.9 Розацеа неуточненного вида | |
| L72 | Фолликулярные кисты кожи и подкожной клетчатки |
| L72.0 Эпидермальная киста | |
| L72.1 Триходермальная киста | |
| L72.2 Стеатоцистома множественная | |
| L72.8 Другие фолликулярные кисты кожи и подкожной клетчатки | |
| L72.9 Фолликулярная киста кожи и подкожной клетчатки неуточненная | |
| L73 | Другие болезни волосяных фолликулов |
L73. 0 Угри келоидные 0 Угри келоидные | |
| L73.1 Псевдофолликулит волос бороды | |
| L73.2 Гидраденит гнойный | |
| L73.8 Другие уточненные болезни фолликулов | |
| L73.9 Болезнь волосяных фолликулов неуточненная | |
| L74 | Болезни мерокринных [эккринных] потовых желез |
| Исключено: гипергидроз (R61.-) | |
| L74.0 Потница красная | |
| L74.1 Потница кристаллическая | |
| L74.2 Потница глубокая | |
| L74.3 Потница неуточненная | |
| L74.4 Ангидроз | |
| L74.8 Другие болезни мерокринных потовых желез | |
| L74.9 Нарушение мерокринного потоотделения неуточненное | |
| L75 | Болезни апокринных потовых желез |
| Исключено: | |
гидраденит гнойный (L73. 2) 2) | |
| дисгидроз [помфоликс] (L30.1) | |
| L75.0 Бромгидроз | |
| L75.1 Хромгидроз | |
| L75.2 Апокринная потница | |
| L75.8 Другие болезни апокринных потовых желез | |
| L75.9 Поражение апокринных потовых желез неуточненное |
Диффузная алопеция (телогеновая алопеция) – Клинические рекомендации
Чаще встречается у женщин во время беременности,
Фазы развития волоса у человека
- Фаза анагена — рост волоса,
продолжительность составляет от 2 до 6 лет (в среднем 3 года), в данной фазе находится приблизительно 80-90 % волос. - Фаза катагена — обратное развитие волосяного фолликула длится около 3 нед.
 Обычно 1% всех волос находятся в фазе катагенеза.
Обычно 1% всех волос находятся в фазе катагенеза. - Фаза телогена — период покоя,
длится около 3 мес., в этой фазе находится приблизительно 10-15 % волос
В норме у человека ежедневно выпадает от 40 до 80 волос,
Каким образом в норме регулируется переход волос из фазы анагена в фазу катагена,
Под влиянием сильного стресса или другого фактора — лихорадки,
При телогеновой алопеции волосы выпадают по всей поверхности волосистой части головы.Отмечается повышенная ломкость и выпадение волос,
Хроническая телогеновая алопеция – постоянный процесс выпадения волос продолжается более 6 месяцев.
Распространенные ситуации,
- Алопеция,
вызванная стрессовыми воздействиями, возникает спустя 2 нед–3 мес после сильных нервных переживаний, чаще у женщин. Волосы вначале выпадают диффузно, а затем у части больных развивается типичная гнездная алопеция. - После лихорадки алопеция возникает спустя 8–10 нед,
проявляется заметным разрежением волос по всей поверхности головы, но полного облысения не наступает. - При беременности алопеция чаще всего возникает в II–III триместре и связана с гормональной перестройкой организма женщины. Зона разреженных волос заметнее в теменной области. Изучение трихограмм показывает,
что во второй половине беременности увеличивается количество волос, находящихся в фазе телогена (25%), скорость роста волос снижается.  В последнем триместре у беременных можно наблюдать либо алопецию лобно-височной области,
В последнем триместре у беременных можно наблюдать либо алопецию лобно-височной области,либо признаки гирсутизма. - Послеродовые алопеции развиваются в первые месяцы после родов и носят характер диффузного облысения,
в основном в височно-теменной области. Количество телогеновых волос резко увеличивается (до 30%). Волосы восстанавливаются полностью через 4–12 месяцев. У некоторых больных выпадение волос может повториться. - Алопеции,
связанные с голоданием или недостаточным питанием, проявляются диффузным выпадением волос на поверхности кожи головы. Характерно истончение оставшихся волос, которые становятся сухими, ломкими. Заболевание может сопровождаться слабостью, отеками, желудочно-кишечными расстройствами. Описано два клинических случая развития гнездной алопеции при целиакии у детей (девочки 29 дней и 13 лет) c выявлением иммуноглобулинов класса A и G; аглютеновая диета приводила к полному восстановлению роста волос в очагах поражения . 
- Алопеция при массивной кровопотере,
очевидно, обусловлена развивающимся дефицитом белков и железа. Диффузное выпадение волос в этих случаях связано с переходом физиологической смены волос в телогеновую фазу. - В некоторых случаях алопеция развивается у женщин,
длительно принимающих гормональные контрацептивы без соответствующего контроля. В подобных случаях процесс может начаться через 2–4 нед и продолжаться в течение 3–4 мес приема контрацептивов. Выпадение волос при этом обусловлено воздействием высоких концентраций эстрогенов на физиологическую смену волос — переход в телогеновый тип. Выздоровление наступает после отмены контрацептивов. - Длительный прием преднизолона приводит к дистрофии матрицы волоса,
фолликулы волос переходят в катагеновую фазу развития. Изучение трихограмм в таких случаях помогает установить диагноз.  Увеличение количества телогеновых волос до 20% считают неблагоприятным показателем.
Увеличение количества телогеновых волос до 20% считают неблагоприятным показателем. - Описано возникновение телогенового выпадения волос через 2–4 мес после аллергического контактного дерматита кожи волосистой части головы на краску для волос,
которое, наиболее вероятно, связано с высвобождением цитокинов в процессе воспалительной реакции .
Диагностика при этом виде алопеции проводится на основании анамнеза,
- Диагноз алопеции в фазе телогена устанавливают при выявлении повышенного выпадения волос спустя 2-4 мес. после перенесенного заболевания или травмы.
- Ежедневный подсчет выпавших волос (пациента просят собирать выпавшие волосы в конверты с указаниям даты и времени). Выпадение более 100 волос в день указывает на заболевание
- Тест на растяжение.Для оценки прочности волос прядь с 30-40 волосами зажимают между большим и указательным пальцем и тянут,
прилагая постоянное усилие.  Выпадение более 6 волос свидетельствует о повышенной ломкости волос.
Выпадение более 6 волос свидетельствует о повышенной ломкости волос.
Показано лабораторное исследование
- Общий анализ крови
- Регулярное исследование мочи
- Исследование в сыворотки крови уровня витамина D
- Исследование гормонов щитовидной железы
- Исследование в сыворотке уровня кальция для диагностики гипокальциемии
- Определение уровния витамина B12 (гиповитаминоз распространеный у вегетарианцев и лиц с пернициозной анемией,
атрофическим гастритом, синдромами мальабсорбции и / или аутоиммунными нарушениями) - Исследование уровня белков сыворотки крови для выявления гипопротеинемии при недоедании
- Исследование в сыворотке крови уровня цинка для выявления его дефицита
- Профиль железа (общая железосвязывающая способность и уровень ферритина в сыворотке) для диагностики дефицита железа
- Уровень анти-мюллерового гормона и тестостерона в сыворотке крови при смешанной алопеции
- Антитела против dsDNA при подозрении на аутоиммунные заболевания.

Трихограмма
Для волос, |
Трихоскопия
|
Трихоскопические особенности андрогенетической и телогеновой алопеций
| Признак | Андроrенетическая алопеция | Телогеновая алопеция |
| Пустующие волосяные фолликулы , | + | + |
| Преобладание во фронтальной зоне одиночных фолликулярных юнитов | ++ | |
| Вертикально отрастающие волосы | +\- | + |
| Истонченные терминальные волосы | + | + |
| Перифолликулярная пигментация (перипилярный знак) | ++ | – |
| Веллусные волосы | + | – |
| Неоднородность диаметров волосяных стержней | + | – |
| Преобладание изменений в лобной области | ++ | – |
Следует установить причину заболевания. Телогеновая алопеция продолжается от 6 месяцев до года. Как правило,
Телогеновая алопеция продолжается от 6 месяцев до года. Как правило,
Предложеные методы лечения применяются с переменным успехом:
- Миноксидил при хроническом течении заболевания (противопоказан при остром процессе) 2% раствор для женщин,
5% – для мужчин - Пищевые добавки,
содержащие железо, цинк, селен, ниацин, фолиевую кислоту, биотин, витамин А, витамин D, витамин Е, жирные кислоты и аминокислоты, играют ключевую роль в содействии росту волос и укреплению структуры волос. Исследования показали связь между дефицитом этих веществ и телогенной алопецией. - Биотин (витамин Н,
В7) 30 мкг в сутки - Обогащенная тромбоцитами плазма (PRP) – аутологичная концентрация тромбоцитов,
содержащихся в небольшом объеме плазмы.  Новый метод лечения выпадения волос,
Новый метод лечения выпадения волос,при котором, благодаря наличию различных факторов роста и молекул клеточной адгезии, происходит ускорение омоложения волосяных фолликулов.
Диффузная алопеция | #09/07 | «Лечащий врач» – профессиональное медицинское издание для врачей. Научные статьи.
Вструктуре всех заболеваний волос нерубцующееся выпадение волос
составляет более 80%, т. е. является наиболее частой причиной
потери волос, поражающей от 30–40% людей в возрасте до
50 лет. Как выраженный косметический недостаток, облысение часто
приводит к психоэмоциональному дискомфорту, снижающему качество жизни,
и вызывает как социальные проблемы, обусловленные ограничением
в выборе профессии, трудоустройстве и социальной перспективы,
так и экономические в связи с длительностью лечения
и его высокой стоимостью. Несмотря на многолетнюю историю этой
проблемы, вопросы этиопатогенеза, диагностики и лечения
нерубцующейся алопеции до сих пор недостаточно изучены,
а современная терминология является запутанной. Имеющиеся
статистические расчеты по распространенности заболеваний волос нередко
противоречивы, отсутствуют данные комплексного изучения патологии
волос.
Несмотря на многолетнюю историю этой
проблемы, вопросы этиопатогенеза, диагностики и лечения
нерубцующейся алопеции до сих пор недостаточно изучены,
а современная терминология является запутанной. Имеющиеся
статистические расчеты по распространенности заболеваний волос нередко
противоречивы, отсутствуют данные комплексного изучения патологии
волос.
Согласно современным публикациям, в последние годы отмечается
тенденция к увеличению количества пациентов с диффузной
потерей волос [3, 10–13]. Жалобы на выпадение волос часто предъявляют
женщины среднего возраста, однако следует обратить внимание на то, что
четкого уровня заболеваемости не зафиксировано. По данным Ф. М. Менг
и Ю. В. Олейникова (2005), в структуре обращаемости во
врачебно-косметологическую лечебницу заболевания волос достигают 8%,
причем количество первичных обращений за последний год увеличилось
в 1,5 раза. Истинная распространенность заболеваний волос
гораздо выше, так как значительное число больных не обращается за
медицинской помощью, считая усиленное выпадение волос нормальным
состоянием. Пациенты посещают врача при выраженном эстетическом
изменении, когда становится заметным расширение пробора и кожа
головы более ощутимо (т. е. видимо) просвечивает через волосы [10,
12, 19]. Ежедневная потеря волос (до 100), равномерная по всей
поверхности волосистой части головы, является нормальным
физиологическим процессом. Однако под влиянием различных внешних
и внутренних факторов синхронность волосяных циклов нарушается
и возникает избыточное выпадение волос (до 1000 волос
в день), что и приводит к алопеции [18]. Для нарушения
биологического ритма роста волос недостаточно только воздействия
средовых триггеров — необходимы определенные генетические
особенности организма [7].
Пациенты посещают врача при выраженном эстетическом
изменении, когда становится заметным расширение пробора и кожа
головы более ощутимо (т. е. видимо) просвечивает через волосы [10,
12, 19]. Ежедневная потеря волос (до 100), равномерная по всей
поверхности волосистой части головы, является нормальным
физиологическим процессом. Однако под влиянием различных внешних
и внутренних факторов синхронность волосяных циклов нарушается
и возникает избыточное выпадение волос (до 1000 волос
в день), что и приводит к алопеции [18]. Для нарушения
биологического ритма роста волос недостаточно только воздействия
средовых триггеров — необходимы определенные генетические
особенности организма [7].
Как упоминалось выше, классификация различных форм диффузной
алопеции является запутанной. Если следовать систематизации диффузной
алопеции по клинико-морфологической характеристике выпадения волос, то
ее можно разделить на телогеновую и анагеновую. Часто к диффузному
облысению относят и андрогенетическую алопецию. Андрогенетическая
алопеция принципиально отличается от двух предыдущих. Во-первых, данная
потеря волос имеет типичное разрежение волос или облысение
в лобной и/или теменной областях. Во-вторых, при андрогенетической
алопеции основными звеньями патогенеза являются избыточное содержание
андрогенов в тканях организма или повышенная чувствительность
к ним специфических рецепторов, а также локальное нарушение
метаболизма андрогенов [7, 16]. Принципиальное различие данных форм
диффузных алопеций отражено в Международной классификации болезней
10-го пересмотра. Согласно данной классификации можно выделить отдельно
андрогенную алопецию и нерубцующуюся потерю волос, которая
включает телогеновое и анагеновое выпадение волос.
Часто к диффузному
облысению относят и андрогенетическую алопецию. Андрогенетическая
алопеция принципиально отличается от двух предыдущих. Во-первых, данная
потеря волос имеет типичное разрежение волос или облысение
в лобной и/или теменной областях. Во-вторых, при андрогенетической
алопеции основными звеньями патогенеза являются избыточное содержание
андрогенов в тканях организма или повышенная чувствительность
к ним специфических рецепторов, а также локальное нарушение
метаболизма андрогенов [7, 16]. Принципиальное различие данных форм
диффузных алопеций отражено в Международной классификации болезней
10-го пересмотра. Согласно данной классификации можно выделить отдельно
андрогенную алопецию и нерубцующуюся потерю волос, которая
включает телогеновое и анагеновое выпадение волос.
Патогенез нерубцующейся потери волос сложен и до сих пор
остается малоизученным. Однако в настоящее время установлено, что
различного рода токсические воздействия или нарушение обмена веществ
влияют на рост волос, что приводит к его истончению. При этом мы
наблюдаем увеличение коэффициента соотношения пушковых волос
к стержневым. Этиологические факторы воздействуют на волосы,
находящиеся в фазе анагена, так как в этот период волосяные
фолликулы имеют высокую метаболическую активность. Это способствует
сокращению фазы анагена (фаза роста) и более быстрому переходу волоса
в телоген (фаза выпадения). Таким образом, в результате к уже
имеющемуся числу волос, находящихся в стадии телогена,
прибавляется дополнительное количество, что приводит к их
обильному выпадению. Изменение соотношения телогеновых
и анагеновых волос вызвано сбоем процессов деления и
дифференциации кератиноцитов, нарушением метаболических процессов,
находящихся в ростковой зоне волосяной луковицы [7, 10].
Уменьшение в размерах самого дермального сосочка является прямым
следствием снижения количества составляющих его клеток, определенная
часть которых расходуется на возмещение клеток соединительнотканной
сумки, потерянных при поступательных вертикальных перемещениях
волосяного фолликула в фазах катагена (промежуточная фаза) и/или
раннего анагена.
При этом мы
наблюдаем увеличение коэффициента соотношения пушковых волос
к стержневым. Этиологические факторы воздействуют на волосы,
находящиеся в фазе анагена, так как в этот период волосяные
фолликулы имеют высокую метаболическую активность. Это способствует
сокращению фазы анагена (фаза роста) и более быстрому переходу волоса
в телоген (фаза выпадения). Таким образом, в результате к уже
имеющемуся числу волос, находящихся в стадии телогена,
прибавляется дополнительное количество, что приводит к их
обильному выпадению. Изменение соотношения телогеновых
и анагеновых волос вызвано сбоем процессов деления и
дифференциации кератиноцитов, нарушением метаболических процессов,
находящихся в ростковой зоне волосяной луковицы [7, 10].
Уменьшение в размерах самого дермального сосочка является прямым
следствием снижения количества составляющих его клеток, определенная
часть которых расходуется на возмещение клеток соединительнотканной
сумки, потерянных при поступательных вертикальных перемещениях
волосяного фолликула в фазах катагена (промежуточная фаза) и/или
раннего анагена. В результате такой клеточной миграции фолликулярная
миниатюризация приобретает прогрессирующий непрерывный характер
и развивается с гораздо большей скоростью, так как укорочена
фаза анагена. Регулировать цикл зрелого волосяного фолликула, у
которого отмечается уменьшение васкуляризации при вступлении
в фазу катагена и восстановление васкуляризации на раннем этапе
анагена, способен фактор роста сосудистого эндотелия (VEGF). Этот
фактор синтезируется различными клетками, включая кератиноциты
и фибробласты. Доказано, что VEGF является фактором роста
в отношении культур клеток кожного сосочка и волосяного
фолликула. В зрелых волосяных фолликулах VEGF обнаруживается во
внутреннем и наружном эпителиальных влагалищах корня волоса
и кожном сосочке. Таким образом, VEGF — молекула, играющая
ключевую роль в обеспечении адекватного капиллярного кровотока
в кожных сосочках и стимуляции роста волос [7].
В результате такой клеточной миграции фолликулярная
миниатюризация приобретает прогрессирующий непрерывный характер
и развивается с гораздо большей скоростью, так как укорочена
фаза анагена. Регулировать цикл зрелого волосяного фолликула, у
которого отмечается уменьшение васкуляризации при вступлении
в фазу катагена и восстановление васкуляризации на раннем этапе
анагена, способен фактор роста сосудистого эндотелия (VEGF). Этот
фактор синтезируется различными клетками, включая кератиноциты
и фибробласты. Доказано, что VEGF является фактором роста
в отношении культур клеток кожного сосочка и волосяного
фолликула. В зрелых волосяных фолликулах VEGF обнаруживается во
внутреннем и наружном эпителиальных влагалищах корня волоса
и кожном сосочке. Таким образом, VEGF — молекула, играющая
ключевую роль в обеспечении адекватного капиллярного кровотока
в кожных сосочках и стимуляции роста волос [7].
J. Headington (1993) выделяет пять функциональных типов телогенового выпадения волос.
- Преждевременное завершение фазы анагена — наиболее частая реакция фолликулов на действие провоцирующих факторов. Волосяные фолликулы, которые еще длительное время должны были находиться в фазе роста, преждевременно вступают в фазу телогена и процесс завершается обильным выпадением волос через 3–5 нед после воздействия провоцирующего фактора.
- Позднее завершение фазы анагена, характерное для послеродового выпадения волос. Большинство фолликулов (вследствие гормональных изменений во время беременности) находится в фазе роста и не переходит в фазу катагена до рождения ребенка. После родов эти фолликулы быстро вступают в фазу катагена, что приводит к выпадению волос через 1–2 мес после родов.
- Укороченная фаза анагена, которая рассматривается как идиопатический процесс, и при этом наблюдается невозможность отрастить волосы привычной длины.
- Преждевременное
завершение фазы телогена, которое характеризуется значительным
укорочением фазы покоя, что способствует быстрому вступлению фолликула
в очередную фазу роста.

- Позднее завершение фазы телогена. Наблюдается у людей, проживающих в условиях короткого светового дня.
Телогеновое облысение (Telogen effluvium) может протекать как в острой, так и в хронической форме. Но в любом случае при нерубцующейся алопеции полного облысения не наступает. Острая телогеновая алопеция длится менее 6 мес, а затем спонтанно или на фоне терапии проходит; хроническая длится более 6 мес, иногда в течение нескольких лет. Больные с хронической телогеновой алопецией отмечают упорное и сильное выпадение волос с волнообразным течением процесса [9, 10].
Аногеновая алопеция (Anogen effluvium) — это внезапная потеря волос,
вызванная воздействием химических агентов или радиации. При этом волосы
выпадают, не переходя в фазу телогена. Внезапное выпадение волос
наблюдается обычно спустя 1–3 нед после воздействия химических
веществ или радиации. Наиболее часто это происходит при терапии
злокачественных опухолей, которая проводится с применением
облучения или цитостатических агентов. В большинстве случаев выпадение
волос, вызванное химиотерапией, полностью обратимо. Иногда вновь
выросшие волосы оказываются здоровее и крепче тех, которые
выпали [12].
В большинстве случаев выпадение
волос, вызванное химиотерапией, полностью обратимо. Иногда вновь
выросшие волосы оказываются здоровее и крепче тех, которые
выпали [12].
Можно выделить несколько этиологических факторов, приводящих к нарушению процесса роста в волосяном фолликуле и, соответственно, разделить различные виды диффузной алопеции.
Диффузная алопеция при инфекциях. Диффузная потеря волос может наблюдаться после гриппа, малярии, инфекционного мононуклеоза, пневмонии, бруцеллеза, брюшного тифа, туберкулеза, сифилиса, при ВИЧ-инфекции. При длительной и рецидивирующей лихорадке каждый приступ вызывает повреждение волосяных фолликулов в одну и ту же фазу цикла их активности. Облысение наступает спустя 2–2,5 мес после тяжелого приступа лихорадки [2, 17].
Медикаментозно-индуцированная диффузная алопеция.
В зависимости от дозы и длительности приема лекарств может
развиваться анагеновая алопеция — при больших дозах,
и телогеновая — при низких. К лекарственным средствам,
провоцирующим выпадение волос, можно отнести следующие группы
препаратов: ретиноиды, антипаркинсонические средства,
β-адреноблокаторы, антикоагулянты, противосудорожные препараты,
блокаторы Н2-рецепторов, цитостатики.
К лекарственным средствам,
провоцирующим выпадение волос, можно отнести следующие группы
препаратов: ретиноиды, антипаркинсонические средства,
β-адреноблокаторы, антикоагулянты, противосудорожные препараты,
блокаторы Н2-рецепторов, цитостатики.
Диффузная алопеция при дефицитных состояниях. Дефицит железа
приводит к диффузной алопеции даже при отсутствии анемии, как
и дефицит цинка, хрома, селена, белкового питания и дефицит
витамина B12 [1, 17]. Распространенной причиной является
и белково-калорийная недостаточность. Корни волос реагируют на
дефицит белков очень быстро: волосы приобретают признаки дистрофии —
уменьшается диаметр волоса, заметно снижается скорость роста. Вторичная
белковая недостаточность развивается при синдроме мальабсорбции,
энтеропатии, нарушениях процессов всасывания и расщепления, что
наблюдается при различных заболеваниях желудочно-кишечного тракта [10].
Диффузная алопеция при хронических заболеваниях. Классическими причинами потери волос являются эндокринные нарушения, в частности гипер- и гипотиреоидизм. При гипотиреоидизме типично поражение бровей. Этот же симптом встречается и при сифилитическом выпадении волос и атопическом дерматите (признак Хертоге). Также можно выделить следующие заболевания: эритродермия, псориаз, системная красная волчанка и др.
Алопеция психосоматическая. Обильное выпадение волос наблюдалось во время войн: оно являлось следствием стрессов, оперативных вмешательств, несчастных случаев.
Идиопатическая хроническая диффузная алопеция. У некоторых
пациентов часто трудно выявить причины потери волос, и поэтому
устанавливается диагноз «идиопатическая хроническая алопеция». Однако
во время диагностики не следует забывать о наличии
андрогенетической алопеции. В. П. Адаскевич и соавт. (2000)
указывают, что почти у 40% пациенток с жалобами на диффузное
поредение волос путем тщательного обследования выявляют повышенный
уровень андрогенов в сыворотке крови.
В. П. Адаскевич и соавт. (2000)
указывают, что почти у 40% пациенток с жалобами на диффузное
поредение волос путем тщательного обследования выявляют повышенный
уровень андрогенов в сыворотке крови.
Интересными являются исследования метаболизма липидов
в волосяном фолликуле, проведенные А. В. Самцовым и А. А.
Божченко (2007). Из выводов, сделанных авторами, следует, что волосяной
фолликул является одной из самых метаболически активных структур
организма человека, нуждающихся в определенных компонентах и источниках
энергии для адекватной продукции здорового волоса. Метаболизм липидов
в волосяном фолликуле занимает весьма важное место в процессе
формирования интегральных веществ стержня волоса и может адекватно
поддерживаться некоторыми фармакологическими препаратами. Среди
веществ, способных выступать в роли своеобразного строительного
материала для структурных компонентов волоса и обеспечивать
энергетическое сопровождение процессов синтеза специфических
цитокератинов, можно выделить: 6-O-d глюкозы линолеат, таурин, катехины
и глюконат цинка [16].
В последние годы многие авторы отмечают наличие связи между алопецией и дефицитом ряда микроэлементов. Ведь от микроэлементного состава волос зависят их физические свойства, форма, цвет, толщина, эластичность, скорость роста. Волосы без достаточного содержания цинка плохо растут, без селена и кремния они истончаются, становятся ломкими, а избыток кремния может усилить «волнистость» волос. Нарушения обмена меди и марганца связаны с преждевременным поседением волос [14, 15]. Так, Т. А. Малова (2005) установила, что у всех обследованных ею детей, больных алопецией, наблюдался выраженный дисбаланс микроэлементов. Автором установлен дефицит следующих эссенциальных микроэлементов: железа, марганца, меди, цинка, кальция. У 100% детей выявлен недостаток селена.
Лечение. При жалобах на выпадение волос традиционно назначается
диагностическая программа для выявления патологии со стороны щитовидной
железы, ЦНС, заболеваний яичников и надпочечников, печени, иммунной
системы и т. д. с целью установления истинной причины
облысения. Часто лечение начинают с наружной терапии, которая
заключается в нанесении лосьонов, бальзамов, масок, гелей на кожу
волосистой части головы, препаратов, содержащих спирты, настойки
красного перца, эфир, назначают электрофорез биологически активных
веществ. Для приема внутрь врачи рекомендуют витамины C, PP,
A, в виде инъекций — витамины B6, B1, B12.
Рекомендуют длительный прием цинка (поливитаминные комплексы,
биологически активные добавки, состав которых специально подобран для
лечения волос). Все эти методы хорошо известны практикующим
дерматологам и косметологам, но нам бы хотелось остановиться на
более современных лекарственных средствах для лечения выпадения волос.
д. с целью установления истинной причины
облысения. Часто лечение начинают с наружной терапии, которая
заключается в нанесении лосьонов, бальзамов, масок, гелей на кожу
волосистой части головы, препаратов, содержащих спирты, настойки
красного перца, эфир, назначают электрофорез биологически активных
веществ. Для приема внутрь врачи рекомендуют витамины C, PP,
A, в виде инъекций — витамины B6, B1, B12.
Рекомендуют длительный прием цинка (поливитаминные комплексы,
биологически активные добавки, состав которых специально подобран для
лечения волос). Все эти методы хорошо известны практикующим
дерматологам и косметологам, но нам бы хотелось остановиться на
более современных лекарственных средствах для лечения выпадения волос.
Исследования последних лет свидетельствуют об эффективности
гомеопатических препаратов в лечении различных видов алопеций
[4–6]. Дополняя традиционное лечение, гомеопатические лекарства
расширяют возможности лечения. Гомеопатия, существуя уже более двухсот
лет, проявила себя эффективным терапевтическим методом, почти без
побочных эффектов. Гомеопатические лекарства особым образом
активизируют резервные силы организма и относятся к так
называемой «регуляторной» терапии. Эффект применения этих препаратов
является результатом взаимодействия веществ, входящих в их состав.
Общим для них является регулирующее и стимулирующее действие
благодаря включению аутогенных механизмов в терапевтические процессы.
Согласно основному принципу гомеопатии, гомеопатические вещества
в низких потенциях воздействуют преимущественно на физическом
уровне на соответствующий орган, ориентируясь на симптом, что
и позволяет оказывать целенаправленное действие при определенном
заболевании. Селенцин — комплексный гомеопатический препарат,
который включает гомеопатические средства, действенные при разных
причинах облысения. Эффективность данного препарата в лечении
диффузных алопеций доказана клиническими наблюдениями [4, 5, 8].
Препарат Селенцин назначается по 8 гранул 3 раза в день
за 30 мин до еды или через 1 ч после еды на фоне обычной
терапии или в качестве монотерапии. Прием препарата должен
продолжаться от 6 до 12 мес и более. Перерывы между месячными
курсами составляют 1–2 нед. Детям до 10 лет назначают по 5
гранул 3–5 раз в день за 30 мин до еды или через
1 ч после еды.
Гомеопатия, существуя уже более двухсот
лет, проявила себя эффективным терапевтическим методом, почти без
побочных эффектов. Гомеопатические лекарства особым образом
активизируют резервные силы организма и относятся к так
называемой «регуляторной» терапии. Эффект применения этих препаратов
является результатом взаимодействия веществ, входящих в их состав.
Общим для них является регулирующее и стимулирующее действие
благодаря включению аутогенных механизмов в терапевтические процессы.
Согласно основному принципу гомеопатии, гомеопатические вещества
в низких потенциях воздействуют преимущественно на физическом
уровне на соответствующий орган, ориентируясь на симптом, что
и позволяет оказывать целенаправленное действие при определенном
заболевании. Селенцин — комплексный гомеопатический препарат,
который включает гомеопатические средства, действенные при разных
причинах облысения. Эффективность данного препарата в лечении
диффузных алопеций доказана клиническими наблюдениями [4, 5, 8].
Препарат Селенцин назначается по 8 гранул 3 раза в день
за 30 мин до еды или через 1 ч после еды на фоне обычной
терапии или в качестве монотерапии. Прием препарата должен
продолжаться от 6 до 12 мес и более. Перерывы между месячными
курсами составляют 1–2 нед. Детям до 10 лет назначают по 5
гранул 3–5 раз в день за 30 мин до еды или через
1 ч после еды.
Среди современных препаратов местного воздействия, рекомендуемых для терапии облысения, на сегодняшний день применяются миноксидил, аминексил и трикосахарид. Наиболее интересным веществом является трикосахарид, выпускаемый под торговым наименованием Фолтене фарма, против выпадения волос для мужчин и женщин. Важным качеством данного лекарственного вещества является дифференцированный подход к лечению алопеций у мужчин и женщин. Лосьон «Фолтене» для мужчин состоит из трех активных компонентов, обладающих синергической активностью: Tricosaccaride + биовитаминный комплекс + Zanthin. Tricosaccaride — запатентованное активное вещество, состоящее из смеси шести мукополисахаридов, которые являются физиологическими компонентами скальпа, что позволяет добиться полного сходства между активным веществом и скальпом. Трикосахарид имеет способность проникать во внутренние слои луковицы волоса и регулирует обмен питательных веществ между кровью и тканями. Вторая составляющая — биовитаминный питательный комплекс, представляющий собой смесь витаминов и аминокислот. И последним компонентом является Zanthin — эффективный антиоксидант растительного происхождения, который в 500 раз эффективнее витамина E. Шампунь «Фолтене фарма для мужчин» также содержит трикосахарид, в сочетании с лосьоном усиливающий терапевтический эффект. Лосьон «Фолтене фарма для женщин» действует на основе синергического воздействия двух активных композиций: трикалгоксила (особое вещество, созданное из морских водорослей, богатое полисахаридами) и биоминерального комплекса.
Таким образом, диффузная алопеция является мультифакториальным заболеванием, которое детерминируется полигенной системой, определяющей наследственное предрасположение, и триггерными факторами, снижающими порог этого предрасположения. Многообразие теорий нарушений метаболических процессов и их влияния на волосяной фолликул указывает на сложность патогенеза данного заболевания, которой объясняется иногда недостаточная эффективность терапии.
Литература
- Рук А., Даубер Р. Болезни волос и волосистой части головы / Пер. с англ. М.: Медицина, 1985. 528 с.
- Аравийская Е. Р., Михеев Г. Н., Мошкалова И. А., Соколовский Е. В. Облысение. Дифференциальный диагноз. Методы терапии // Серия «Библотека врача-дерматовенеролога». Вып. 7 / под ред. Е. В. Соколовского. СПб.: СОТИС, 2003. 176 с.
- Адаскевич В. П., Мяделец О. Д., Тихоновская И. В. Алопеция. М.: Медицинская книга; Н. Новгород: изд-во НГМА, 2000. 192 с.
- Баткаев Э. А., Галлямова Ю. А. Комплексный гомеопатический препарат «Селенцин» в лечении Telogen effluvium // Вестник последипломного медицинского образования. М., 2002. № 3. С. 42–43.
- Баткаев Э. А., Галлямова Ю. А., Кантимирова Ю. А. Гомеопатические препараты в практике дерматолога: учебное пособие. М., 2006. 30 с.
- Гаджигороева А. Г., Нечаева Н. П. Применение трихограммы для оценки эффективности лечения выпадения волос // II Всероссийский конгресс дерматовенерологов, 2007. С. 52.
- Гаджигороева А. Г. Лечение пациентов с телогеновым выпадением волос // Вестник дерматологии и венерологии. 2004. № 4. С. 43–46.
- Готовский Ю. В., Перов Ю. Ф. Особенности биологического действия физических факторов малых и сверхмалых интенсивностей и доз. М.: Имедис, 2000. 192 с.
- Колюжная Л. Д., Михнева Е. Н. Клинические и патогенетические особенности диффузной и андрогенетической алопеции // Вестник дерматологии и венерологии. 2003. № 1. С. 25–27.
- Мазитова Л.. Влияние эндокринных, метаболитических и химических факторов на выпадение волос и их структуру у женщин // Les Nouvelles Esthetiques. Русское издание. 2002. № 1. С. 40–42.
- Малова Т. А. Роль нарушений микроэлементного гомеостаза в патогенезе развития алопеции у детей // Проблемы дерматовенерологии и медицинской косметологии на современном этапе. Владивосток, 2005. С. 111–112.
- Марголина А. А., Эрнандес Е. И. Борьба за волосы. М.: 1999. 102 с.
- Менг Ф. М., Олейникова Ю. В. Современные аспекты распространенности заболеваний волос среди населения // Проблемы дерматовенерологии и медицинской косметологии на современном этапе. Владивосток, 2005. С. 167–170.
- Скальный А. Волосы — ключ к тайнам человеческой индивидуальности // Les Nouvelles Esthetiques. Русское издание. 2003. № 4. С. 58–60.
- Савченко В. М. Микроэлементы и витамины при местном лечении себорейного облысения // Натуральная фармакология и косметология. 2005. № 4. С. 18–19.
- Самцов А. В., Божченко А. А. Андрогенетическая алопеция: некоторые аспекты нарушений тканевого метаболизма сально-волосяного аппарата и современные подходы к их коррекции // Клиническая дерматология и венерология. 2007. № 4. C. 4–8.
- Суворова К. Н., Хватова Е. Г. Клинические аспекты диагностики в трихологии. Экспериментальная и клиническая дерматокосметология. 2005. № 2. С. 54–57.
- Olsen E. A. Hair Disorder // in Fitzpatrik’s Dermatology in general medicine // McGraw-Hill. 1999. p. 729–749.
- Dawber R. P. R., Martimer P. S. Hair loss during lithium treatment // Br. J. Dermatol. 1982; 107: 124–5.
- Headington J. T. Telogen effluvium. New concept and review // Arch. dermatol. 1993; Mar, 129(3): 356–63.
Ю. А. Галлямова, доктор медицинских наук
Аль-хадж Хассан Халед
М. П. Чернышова
РМАПО, Москва
Выпадение волос код по мкб 10
Алопеция мкб 10: классификация заболевания по типам
Содержание
- 1. Разновидности плешивости
В МКБ-10 рассматриваемое заболевание легко распознать по кодам L63, L63.1, L63.2, и так далее вплоть до L64.9. Алопеция представляет собой патологическое выпадение волос с последующей самозаменой места их выпадения соединительной тканью.
Алопеция, согласно международному справочнику болезней, по симптомам и внешнему виду пораженного участка волосяного покрова делится на четыре основных вида:- Гнездная;
- Диффузная;
- Очаговая;
- Тотальная.
Наиболее распространена очаговая алопеция, местом проявления которой является волосяной покров кожи головы. Она распознаётся по коду L63.2 и поражает не всю площадь покрова, а некоторую его часть, или очаг. Причём бывает так, что возникает сразу несколько очагов в разных местах. Постепенно разрастаясь, проплешины способны приводить к полному облысению.
Код по МКБ-10 L63.0 означает тотальную плешивость. Симптоматика данной патологии включает в себя практически полное(94%) отсутствие волос на голове. Болезнь, в основном, поражает головы мужчин.
Гнездная алопеция имеет индекс в международном справочнике болезней L63.2. В момент пребывания в состоянии заболевания на голове больного наблюдаются лысые участки округлой, иногда кольцевидной и гнездовидной формы, отсюда и название патологии. Гнездная плешивость передаётся по наследству и обычно поражает головы мужчин и женщин среднего и старшего возраста.
L63.8 – это код МКБ-10, под которым значится диффузная алопеция. В отличие от предыдущих типов облысения, данная плешивость распространяется по всей площади кожи головы и представляет собой поредение волос. У больного отмечается резкое понижение числа здоровых волосяных фолликул. Оставшиеся волосы становятся неспособными покрыть кожу головы на все 100 %.
Из-за недостатка волос при диффузном облысении виднеется кожа головы больного, что обычно наблюдается у людей пожилого возраста.
Согласно МКБ-10, все типы плешивости, в том числе и гнездная, поддаются лечению препаратами, способными действовать на генном уровне. В основном, это всевозможные кортикостероидные препараты и фотосенсибилизаторы. В крайних случаях может помочь пересадка волос.
Автор статьи: Ольга Арсеньева
gialuron.com
Диффузное облысение является симптоматическим заболеванием
Согласно международной классификации болезней МКБ-10 диффузное выпадение волос имеет номер: L65.
При этом типе облысения наблюдается частичное, неполное и фактически равномерное уменьшение волосяного покрова на всей поверхности головы. Существует настолько большое количество разных внешних и внутренних факторов, которые могу привести к диффузному облысению и нарушению нормального цикла развития волос, что их невозможно все перечислить. В отличии от других типов облысение, при данном типе, наибольшие потери происходят через 2-4 месяца после действия провоцирующего фактора.
Содержание
- 1 Причины
- 2 Больше информации и советов
Причины
Наиболее частой причиной диффузного выпадения волос, является перенесенное инфекционное заболевание, например грипп у взрослых и ветрянка у детей. Перенесенная хирургическая операция, неправильное голодание и питание, заболевания щитовидной железы. Часто выпадение волос встречается при различных заболеваниях иммунной системы. Может встречаться у людей с сахарным диабетом и у лиц с заболеваниями почек, печени и крови.
Диффузного выпадения часто происходит у женщин после родов, волосяной покров обычно восстанавливается через 4-9 месяцев после родов. Лекарственные препараты так же могут вызвать сильную потерю волос: обычно это наблюдается при лечении антикоагулянтами, аллопуринолом, ингибиторами АПФ, бета-блокаторами, препаратами лития, оральными контрацептивами и тиреостатиками. Психическое перенапряжение, стресс и психические заболевания так же способствуют диффузному выпадению волос.
Обследование человека с диффузным выпадением, включает внешний осмотр, выявление острого или хронических заболевания, физического и психического напряжения за 3-6 месяцев до начала облысения. В зависимости от этих данных, возможно, понадобятся дополнительные лабораторные обследования. Обычно проверяется гемоглобин, С — реактивный белок, железо, глюкоза, гормоны щитовидной железы, лейкоцитарная формула, АЛАТ, ОАМ, креатинин.
Так как этот вид выпадения волос является симптоматическим, то лечение направлено на устранение вероятной первопричины. Если причина устранена, то нормальный волосяной покров, как правило, восстанавливается постепенно в течение 5-12 месяцев самостоятельно. Полное облысение или тотальная алопеция не наступает. Применение различных различного рода стимуляторов роста волос, витаминов и минералов не имеет научно доказанного эффекта и в шведской медицинской практике не применяется.
Больше информации и советов
swedmed.ru
Диффузная алопеция мкб – Все о росте волос
НАШИ ЧИТАТЕЛИ РЕКОМЕНДУЮТ!
Для восстановления волос наши читатели успешно используют Миноксидил. Видя, такую популярность этого средства мы решили предложить его и вашему вниманию. Подробнее здесь…
В современной медицине существует такое понятие, как алопеция. «Что это такое, и как с этим бороться?» – вопросы, которые задают многие люди. Алопеция по мкб-10 относится к болезням кожи и подкожной клетчатки.
На самом деле с этим понятием знаком каждый. То, что в народе называют облысением, в соответствии с мкб-10 обозначается термином алопеция. Это частичное или полное выпадение волос на голове и теле. По данным мкб-10 облысение может появиться как у женщин, так и у мужчин. Различным бывает лишь характер проявления и клиническая картина.
У мужчин чаще наблюдается полная или локальная потеря волосинок, в то время как женщинам больше характерно общее поредение. Облысение, или по-научному алопеция, не угрожает жизни и здоровью человека, но может быть связано с более серьезными нарушениями. Как правило, данная болезнь поражает волосистые области головы.
Причинами и лечением алопеции занимаются только врачи, самолечением заниматься не стоит!
Виды алопеции
Различают несколько видов данного нарушения. Единой классификации нет, но в зависимости от симптомов и провоцирующих факторов выделяют такие виды алопеции:
- врожденная;
- себорейная;
- симптоматическая;
- гнездная;
- рубцовая;
- преждевременная.
Чтобы определить, какой именно вид заболевания имеет место в конкретном клиническом случае, пациенту необходимо пройти полную диагностику. Симптомы алопеции многое говорят о причинах ее появления. Болезнью облысения, как правило, занимаются дерматологи и трихологи.
Врожденная алопеция
Врожденная патология – явление достаточно редкое. Такое нарушение характеризуется полным облысением либо частичным проредением волосинок. Как самостоятельное нарушение алопеция этой формы, как правило, не проявляется. Чаще всего ей сопутствуют дополнительные дефекты. Это могут эктодермальные или кожные нарушения, к которым относят дистрофия ногтей, зубов.
Однако в медицинской практике известны случаи, когда врожденная форма является самостоятельной болезнью. Причины этого вида кроются в генетической предрасположенности человека.
Признаки заболевания
Данная болезнь проявляется с самого детства. Родители могут наблюдать у своего ребенка редкие, тонкие, ломкие волоски. При этом волосяной покров настолько жидкий, что практически не покрывает полностью головку. Тотального отсутствия волос, как правило, не наблюдается.
Лечение
Добиться восстановления утраченных волосинок и увеличения густоты невозможно. Генетика устроена так, что на нее подчас невозможно повлиять. Специфическое лечение, а также систематическое применение укрепляющих препаратов и витаминов поможет защитить оставшиеся волоски, замедлить их выпадение.
Радикальный метод лечения включает в себя пересадку кожи головы. На место, которое полностью облысело, пересаживается эпидермис с активными волосяными луковицами. Рост волос после этого восстанавливается.
Это самая распространенная форма болезни. Ее называют также андрогенной. Преждевременной патологии больше подвержены мужчины. Практически все случаи облысения у лиц мужского пола происходят из-за преждевременной потери волосинок.
Признаки заболевания
Процесс закладывается еще в детстве, когда идет активное половое созревание. Если у парня в этот период обнаруживаются первичные признаки облысения головы, то примерно к тридцати пяти годам данное заболевания проявится наиболее ярко.
Развитие болезни начинается на генетическом уровне. В период полового созревания мужской гормон тестостерон, а именно его разновидность – дигидротестостерон, активно влияет на волосяные фолликулы и провоцирует их преждевременное отмирание. Это и есть основные причины. Так как преждевременная форма связана с мужскими гормонами, то и влияет она преимущественно на мужчин.
Через несколько лет после того как болезнь начинает прогрессировать, волоски выпадают полностью. Особенно это касается лобной и теменной частей головы. На крайних участках волосистость сохраняется. Традиционное лечение в этом случае также малоуспешно.
У женщин тоже диагностируют преждевременное поредение волосяного ряда. Но признаки алопеции данного вида несколько отличаются от того, что происходит у мужчин. У представительниц слабого пола не наблюдается тотального облысения. Здесь идет речь скорее о поредении, которое начинается раньше положенного возраста.
Лечение
С таким нарушением можно бороться при помощи лекарственных препаратов, лазерного излучения в малых дозах. Выпадение волос у женщин является достаточно серьезной эстетичной проблемой, поэтому часто прибегают к радикальному методу – трансплантации волос. Трансплантация волосяных луковиц является самым надежным способом терапии, так как только такое лечение восстанавливает полноценный рост и возвращает природную густоту.
Себорейная алопеция
Себорейная алопеция, причины которой являются проявлениями одноименной болезни себореи, протекает с ярко выраженными симптомами, но по данным мкб-10 легко поддается лечению.
Сама по себе себорея поражает кожный покров головы, что, естественно, сказывается и на состоянии волос. При этом поражаются сальные железы, и нарушается процесс отделения кожного сала.
Признаки заболевания
Жирность кожи повышается, нарушается нейроэндокринная регуляция организма в целом и все это ведет к выпадению волосинок, шелушению кожи, микротрещинам эпидермиса на голове и т. д.
Потеря волос в этом случае полностью зависит от стадии себореи и течения заболевания. Симптомы патологии приумножаются с развитием и прогрессированием себореи.
Лечение
Вылечив себорею, врачи уберут причины облысения. Чем скорее начать лечение основной болезни, тем больше шансов восстановить густоту и объем шевелюры. Лечение включает в себя определенные медикаменты, физиологические процедуры, общеукрепляющие витаминные комплексы.
Симптоматическая алопеция
Международная классификация болезней 10-го пересмотра выделяет еще и симптоматическую форму. Она появляется после перенесенных ранее тяжелых инфекционных или хронических заболеваний. К болезням, провоцирующим симптоматический тип, относят сифилис, авитаминоз, болезнь соединительной ткани, острое отравление и т. д.
Также данная форма может дать о себе знать после лучевой болезни, интоксикации организма.
Признаки заболевания
Поражение происходит очагами, диффузно или тотально. Характер проявления зависит от общего состояния здоровья человека и провоцирующих факторов. Для исцеления достаточно убрать причину, придерживаться здорового образа жизни, перейти на здоровую пищу, употреблять больше витаминов и белков.
Рубцовая алопеция
Рубцовая алопеция наблюдается не только в областях головы, она может поражать любой волосистый участок тела.
Признаки заболевания
Эпителиальная ткань замещается соединительной. Проще говоря, на коже образуются шрамы из-за действия определенных факторов.
Провоцировать появление пораженных участков эпителия могут красная волчанка, грибковые поражения, механические травмы, химические поражения, ожоги, наращивание волос, ношение тугих хвостов и т. д. Причины облысения такой формы носят в основном бытовой характер и провоцируются невнимательным отношением к своему здоровью.
Лечение
Полное восстановление волос при помощи местного и медикаментозного лечения возможно только в том случае, если алопеция вызвана конкретным заболеванием. Если же причинами облысения послужили механические повреждения кожи, то здесь поможет только трансплантация.
Гнездная алопеция
Гнездный (очаговый) вид по 10-й классификации еще до конца не изучен. Его причины точно неизвестны медицине. Когда говорят о провоцирующих факторах, врачи склоняются к эндокринным нарушениям, инфекционным заболеваниям и токсическому влиянию на организм.
Признаки заболевания
Характерными симптомами данной формы являются очаговые облысения кожи головы, тела. Круглые зоны полностью лишаются волосинок. Они могут быть большими, а могут занимать лишь несколько миллиметров. Заболевание прогрессирует, если вовремя не принять меры по его предотвращению.
Лечение неэффективно, так как медики еще не нашли определенного медикамента для терапии данной формы облысения. Однако приостановить и частично восстановить волосистость все же реально.
Главное, не запускать течение гнездной алопеции и вовремя обратиться за помощью к квалифицированному специалисту!
oroste-volos.ru
Другая нерубцующая потеря волос
МКБ-10 → L00-L99 → L60-L75 → L65.0
Телогенное выпадение волос
L65.1L65.8Другая уточненная нерубцующая потеря волос
L65.9Нерубцующая потеря волос неуточненная
скрыть | раскрыть
- Некоторые инфекционные и паразитарные болезниA00-B99
- НовообразованияC00-D48
- Болезни крови, кроветворных органов и отдельные нарушения, вовлекающие иммунный механизмD50-D89
- Болезни эндокринной системы, расстройства питания и нарушения обмена веществE00-E90
- Психические расстройства и расстройства поведенияF00-F99
- Болезни нервной системыG00-G99
- Болезни глаза и его придаточного аппаратаH00-H59
- Болезни уха и сосцевидного отросткаH60-H95
- Болезни системы кровообращенияI00-I99
- Болезни органов дыханияJ00-J99
- Болезни органов пищеваренияK00-K93
- Болезни кожи и подкожной клетчаткиL00-L99
- Болезни костно-мышечной системы и соединительной тканиM00-M99
- Болезни мочеполовой системыN00-N99
- Беременность, роды и послеродовой периодO00-O99
- Отдельные состояния, возникающие в перинатальном периодеP00-P96
- Врожденные аномалии [пороки развития], деформации и хромосомные нарушенияQ00-Q99
- Симптомы, признаки и отклонения от нормы, выявленные при клинических и лабораторных исследованиях, не классифицированные в других рубрикахR00-R99
- Симптомы и признаки, относящиеся к системам кровообращения и дыханияR00-R09
- Симптомы и признаки, относящиеся к системе пищеварения и брюшной полостиR10-R19
- Симптомы и признаки, относящиеся к коже и подкожной клетчаткеR20-R23
- Симптомы и признаки, относящиеся к нервной и костно-мышечной системамR25-R29
- Симптомы и признаки, относящиеся к мочевой системеR30-R39
- Симптомы и признаки, относящиеся к познавательной способности, восприятию, эмоциональному состоянию и поведениюR40-R46
- Симптомы и признаки, относящиеся к речи и голосуR47-R49
- Общие симптомы и признакиR50-R69
- Отклонения от нормы, выявленные при исследовании крови, при отсутствии установленного диагнозаR70-R79
- Отклонения от нормы, выявленные при исследовании мочи, при отсутствии установленного диагнозаR80-R82
- Отклонения от нормы, выявленные при исследовании других жидкостей, субстанций и тканей организма, при отсутствии установленного диагнозаR83-R89
- Отклонения от нормы, выявленные при получении диагностических изображений и проведении исследований, при отсутствии установленного диагнозаR90-R94
- Неточно обозначенные и неизвестные причины смертиR95-R99
- Травмы, отравления и некоторые другие последствия воздействия внешних причинS00-T98
- Внешние причины заболеваемости и смертностиV01-Y98
- Факторы, влияющие на состояние здоровья населения и обращения в учреждения здравоохраненияZ00-Z99
- Коды для особых целейU00-U85
скрыть всё | раскрыть всё
Международная статистическая классификация болезней и проблем, связанных со здоровьем.10-ый пересмотр.
С изменениями и дополнениями, опубликованными ВОЗ в 1996-2018 гг.
xn—10-9cd8bl.com
Алопеция – это… Что такое Алопеция?
Алопе́ция[1] (лысость, от др.-греч. ἀλωπεκία через лат. alopecia — облысение, плешивость) — патологическое выпадение волос, приводящее к их поредению или полному исчезновению в определенных областях головы или туловища. К наиболее распространенным видам алопеции относится андрогенетическая (androgenetic), диффузная или симптоматическая (effluviums), очаговая или гнездная (areata), рубцовая (scarring).[2][3]
Андрогенетическая алопеция
Андрогенетическая алопеция (андрогенная — неправильно) представляет собой истончение волос, ведущее у мужчин к облысению теменной и лобной областей, у женщин — к поредению волос в области центрального пробора головы с распространением на ее боковые поверхности.[4]
Степень выраженности андрогенетической алопеции характеризуется для мужчин по шкале Норвуда, для женщин — по шкале Людвига.
Свыше 95 % всех случаев облысения мужчин происходит по причине андрогенетической алопеции.[5] Данные по частоте проявления андрогенетической алопеции у женщин значительно расходятся — от 20 % до 90 % всех случаев потери волос, что связано с менее заметным и труднее диагностируемым проявлением этой алопеции у женщин.
Причины развития андрогенетической алопеции лежат на генном уровне и заключаются в повреждающем воздействии на волосяные фолликулы активной формы мужского полового гормона тестостерона — дигидротестостерона, образующегося под влиянием фермента 5-альфа-редуктазы, находящегося в волосяных фолликулах. Дигидротестостерон, проникая в клетки фолликулов, вызывает дистрофию последних и, соответственно, дистрофию производимых ими волос. Волосы на голове остаются, но они становятся тонкими, короткими, бесцветными (пушковые волосы) и уже не могут прикрыть кожу головы — образуется лысина. Через 10-12 лет после проявления алопеции устья фолликулов зарастают соединительной тканью, и они уже не могут производить даже пушковые волосы.
Так как в женском организме тестостерон и 5-альфа-редуктаза присутствуют тоже, то развитие андрогенетической алопеции у женщин в принципе такое же, как у мужчин, различаясь в основном клинической картиной.
Чувствительность волосяных фолликулов к дигидротестостерону зависит большей частью от набора генов человека, то есть, определяется наследственностью. Считается, что склонность к потере волос в 73-75 % случаев наследуется по материнской линии, в 20 % — по отцовской, и лишь 5-7 % предрасположенных к андрогенетической алопеции являются первыми в роду.[6] В последнее время удалось определить, какие особенности в ДНК человека с большой вероятностью могут вызывать потерю волос, и эти данные уже используются на практике для определения склонности к наследственному облысению как мужчин, так и женщин.[7]
Современная медицина предлагает три подхода к борьбе с андрогенетической алопецией — лекарственная терапия, лазерная терапия и трансплантация собственных волос.
Из лекарственных препаратов на сегодняшний день только два клинически доказали свою эффективность и безопасность при лечении андрогенетической алопеции и получили одобрение Европейского медицинского агентства (European Medicines Agency) и Управления контроля качества продуктов и лекарств в США ( U.S. Food and Drug Administration) — препарат для топического применения миноксидил (принадлежит к группе активаторов (открывателей) калиевых каналов) (регейн в Европе, роугейн в США) и препарат для внутреннего применения финастерид (торговая марка пропеция — финастерида 1 мг), последний рекомендуется только мужчинам. Препараты помогают не всем и не способны вылечить андрогенетическую алопецию, а только дают возможность поддерживать приемлемое состояние волос, пока терапия применяется. После прекращения приема препаратов волосы возвращаются в исходное состояние в срок от нескольких месяцев до года.
Низкоинтенсивное лазерное излучение также клинически доказало свою эффективность и одобрено указанными выше органами для лечения андрогенетической алопеции путем использования в домашних условиях лазерной расчески. В условиях медицинских центров применяются более мощные клинические лазерные установки. Эффективность лазерной расчески невысока. Клинические лазерные установки дают существенно более выраженный эффект. Как и при лекарственной терапии, прекращение лазерной терапии приводит к деградации волос до исходного состояния.
Трансплантация собственных волос — это хирургический путь решения проблемы. Хирург берет волосяные фолликулы из затылочных и боковых отделов поверхности головы, где фолликулы не подвержены влиянию дигидротестостерона (андрогеннезависимые зоны), и переносит их в места облысения. После пересадки фолликулы продолжают функционировать в обычном режиме, и из них вырастают нормальные здоровые волосы, сохраняющиеся до конца жизни. Однако не все кандидаты на трансплантацию волос подходят для этой операции, и не всегда отдаленные результаты операции оказываются удовлетворительными.
В настоящее время в мире ведутся активные разработки перспективных методов восстановления волос при андрогенетическом облысении. Наибольшие ожидания у интересующихся этим вопросом связаны с технологиями клонирования волос и стимуляции роста новых волос.
Суть первой технологии состоит в клонировании волосяных фолликулов, взятых из андрогеннезависимых зон поверхности головы, с последующим внедрением полученных клонов в облысевшие участки кожи головы по специальной методике.
Разработки второй технологии основываются на установленном факте, что при заживлении ран на участках кожи с волосами активизируется белок, обозначаемый как Wnt, который каким-то образом способствует появлению на месте ранения новых волосяных фолликулов. Волосы, появляющиеся из них, нормально проходят все циклы развития. Ученые считают, что можно заставить Wnt производить новые фолликулы и на неповрежденной коже.
Диффузная алопеция
Диффузная алопеция характеризуется сильным равномерным выпадением волос по всей поверхности волосистой части головы у мужчин и женщин в результате сбоя циклов развития волос. Так как диффузная алопеция является следствием нарушений в работе всего организма, её иногда называют симптоматической. По распространенности диффузная алопеция занимает второе место после андрогенетической алопеции. Женщины подвержены ей в большей степени, чем мужчины.
Выделяют телогеновую и анагеновую форму диффузной алопеции. При более часто встречающейся телогеновой форме после спровоцировавшей алопецию причины до 80 % волосяных фолликулов досрочно уходят в фазу телогена (покоя), прекращая производить волосы.
Телогеновую форму алопеции могут вызвать:
Анагеновая форма диффузной алопеции возникает при воздействии на организм, и волосяные фолликулы в частности, более сильных и быстродействующих факторов, в результате чего волосяные фолликулы не успевают «спрятаться» в фазе покоя, и волосы начинают выпадать сразу из фазы роста (анагена). Такими факторами обычно бывают радиоактивное излучение, химиотерапия, отравление сильными ядами.
В большинстве случаев после исчезновения причины диффузной алопеции выпавшие волосы полностью восстанавливаются в срок 3-9 месяцев, так как здесь, в отличие от андрогенетической алопеции, не происходит гибели волосяных фолликулов. Поэтому лечение диффузной алопеции направлено, в первую очередь, на поиск и ликвидацию вызвавшей её причины. После исчезновения причины для более быстрого восстановления волос применяют различные стимуляторы их роста — миноксидил, лечебные бальзамы, физиотерапию.
Очаговая алопеция
Очаговая (гнездная) алопеция представляется в виде одного или нескольких округлых очагов облысения разных размеров, располагающихся на волосистой части головы, в области бровей, бороды, ресниц или туловища. При развитии болезни очаги, увеличиваясь, могут сливаться друг с другом, образовывая области поражения произвольной формы.
Если в результате прогрессирования болезни на волосистой части головы происходит полное её облысение, алопеция называется тотальной. Иногда происходит полное выпадение волос на всём теле — тогда алопеция называется универсальной.
По разным данным частота проявления очаговой алопеции среди всех видов облысения составляет от 0,5 % до 2 %.
Для очаговой алопеции характерно быстрое развитие и часто самопроизвольное окончание заболевания с полным восстановлением волос. Однако примерно в 30 % случаев болезнь либо постоянно прогрессирует, либо длится в виде циклов выпадения-восстановления волос.
Причины и механизм развития очаговой алопеции изучены плохо. Считают, что такими причинами могут быть нарушения в иммунной системе, генетическая предрасположенность к заболеванию, стрессы, плохая экология, физические травмы и острые заболевания.
Для лечения очаговой алопеции не существует ни специальных лекарств, ни одобренных методов лечения. Наиболее распространённым методом лечения алопеции является применение кортикостероидов в различных формах (в виде кремов, инъекций, оральных препаратов)[8] или препаратов, стимулирующих выделение собственных кортикостероидов. Однако будучи способными стимулировать рост волос в зонах поражения, кортикостероиды не излечивают саму болезнь и не могут предотвратить появление новых очагов облысения.
Рубцовая алопеция
Общей чертой различных форм рубцовой алопеции является необратимое повреждение волосяных фолликулов и появление на их месте соединительной (рубцовой) ткани. В структуре видов облысения рубцовая алопеция составляет 1-2 %.
Причиной рубцовой алопеции могут быть инфекции (вирусные, бактериальные, грибковые), вызывающие воспалительные реакции вокруг волосяных перитрихов, на месте которых в результате появляется соединительная ткань. Если лечение инфекции произведено своевременно, волосы могут сохраниться.
Рубцовая алопеция часто возникает в результате физических травм — ранений, тепловых или химических ожогов.
Для лечения сформировавшейся алопеции существует только один метод — хирургический. Либо места облысения удаляются, если они не слишком большие, либо в эти места трансплантируются здоровые фолликулы из областей, не затронутых алопецией.
Встречается ещё целый ряд более редких форм алопеции, описанных, например, в [2].
Трансплантация волос
Существуют 2 вида операций по пересадке волос.
Первый вид это стрип-метод, в котором для пересадки используют лоскут кожи вырезанный из донорской зоны на затылочной части. Лоскут разрезается на графты (графт содержит 1-3 луковицы волос) и пересаживается.
Самым современным способом пересадки является бесшовный (фолликулярный) метод, при котором волосяные луковицы извлекаются из донорской зоны по одной специальным инструментом. В данном случае, при недостаточном количестве волос на затылочной части головы, донорской зоной могут являться подбородок, грудь, ноги, паховая область.
На сегодняшний день пересадка волос является единственным[источник не указан 471 день] эффективным способом восстановления волос и лечения облысения. Приживаемость пересаженных волос более 95%.
Известные лысые
Примечания
Ссылки
- American Hair Loss Association. — Американская ассоциация против облысения. Ассоциация объединяет ведущих специалистов США по данной проблеме. Одной из главных целей ассоциации является широкое разъяснение причин облысения и методов борьбы с ним. Архивировано из первоисточника 20 февраля 2012. Проверено 27 февраля 2010.
- Война с облысением. — Достаточно полно и с современных позиций освещены основные виды алопеций и методы борьбы с ними. Публикуется информация о последних научных и практических достижениях в лечении алопеций. Проверено 27 февраля 2010.
Кыргызская государственная медицинская академия имени И. К. Ахунбаева
Кыргызская государственная медицинская академия имени И. К. Ахунбаева- Об Академии
- Образование
- Наука и лечебная работа
- Международное сотрудничество
- Жизнь студента
- Медиа
Знание, Oпыт и Инновации.Scientia, Experientia et Novitates.
Конференции006 Окт
Образование016 Сен
Университетская жизньПонедельник, 20 Сентября 2021 0
ДостиженияЧетверг, 16 Сентября 2021 0
ПартнёрствоЧетверг, 16 Сентября 2021 0
Университетская жизньСреда, 15 Сентября 2021 0
ПартнёрствоПонедельник, 13 Сентября 2021 0
Университетская жизньПонедельник, 13 Сентября 2021 0
Университетская жизньПятница, 10 Сентября 2021 0
ПартнёрствоВторник, 7 Сентября 2021 0
Университетская жизньВторник, 7 Сентября 2021 0
Среда, 15 Сентября 2021
Среда, 15 Сентября 2021
Пятница, 10 Сентября 2021
Пятница, 10 Сентября 2021
Пятница, 3 Сентября 2021
Понедельник, 12 Июля 2021
Университетская жизньСреда, 7 Июля 2021
Университетская жизньСреда, 7 Июля 2021
Университетская жизньПятница, 11 Июня 2021
Вторник, 21 Сентября 2021
Вторник, 21 Сентября 2021
Понедельник, 20 Сентября 2021
Понедельник, 20 Сентября 2021
Пятница, 17 Сентября 2021
Пятница, 17 Сентября 2021
Пятница, 17 Сентября 2021
Четверг, 16 Сентября 2021
Четверг, 16 Сентября 2021
Четверг, 16 Сентября 2021
Среда, 15 Сентября 2021
Понедельник, 13 Сентября 2021
Рекомендации МГНОТ по COVID-19 и постковидному синдрому 2021
8.1 Образ болезни
Клинические проявления и лабораторные характеристики постковидного синдрома варьируют в широких пределах. Патогномоничных симптомов – признаков, позволяющих однозначно поставить диагноз – у этой болезни нет. ПЦР даже в остром периоде болезни имеет допущения как по частоте положительных тестов (не все позитивные тесты являются основание для диагноза), так и по негативным тестам – лишь у части больных с инфекцией COVID-19, возможно у 30-40%, имеется позитивные результаты ПЦР. Более специфичны Ig, однако частота выявления повышенных их значений различна в различные периоды болезни: от 30% в первые недели болезни до 90% к 3-4 неделе с последующим быстрым снижением частоты выявляемости повышенных значений (ссылка на Кохрейн). Однако изучение большого числа случаев, сопоставление повторяющихся симптомов позволяет сформировать картину признаков заболевания – образ болезни. Для этого можно и нужно использовать формализованные системы автоматического учета жалоб и анамнеза пациентов. МГНОТ разработало 2 опросника на основе платформы MeDiCase для получения данных о симптомах заболевания как в остром периоде болезни, так и на стадии постковидного синдрома: опросы в общей сложности с мая-июня 2020 г. прошло более 20 тысяч человек. Учитывая неразрывную связь острого COVID-19 и постковидного синдрома, приводим результаты формирования образа болезни для обоих стадий процесса.Образ болезни острого COVID-19: на первом этапе на основе литературных данных и знаний врачей были выделены вопросы для диагностики (симптомы), которые были внесены в систему. Опрос респондентов проводился в открытом доступе в сети интернет, участником опроса мог стать любой желающий. (www.medicase.pro/covid19) На момент анализа результатов опроса (август 2020 г.), системой воспользовались 4 900 человек. Из общей совокупности для анализа было отобрано 2 695 сессий, в которых были полностью заполнены все необходимые поля и отмечено, что респонденты правильно отвечали на вопросы. Система выдавала более 1 диагностической гипотезы у человека.
Симптомы заболевания выявлены у 1 268 человек (47,05%), соответственно у них система заподозрила COVID-19 легкой и средней степени тяжести. Возможное заражение (иначе говоря – был контакт с заболевшим, но не было достаточного числа симптомов, чтобы диагностировать болезнь – «малосимптомное течение») было определено у 1 323 человек (49,09%). У 72,2% респондентов были контакты с больными. Позитивные результаты лабораторных исследований на COVID-19 (ПЦР) и исследования Ig были получены у 411 человек (15,25%).
Были сформированы 3 группы: 1 (n=1870) – установлена диагностическая гипотеза заболевания или возможного заражения («малосимптомное течение»), 2 (n=120) – имеется лабораторно подтвержденный диагноз COVID-19 (ПЦР или антитела) и 3 (n=291) – респонденты с отрицательными результатами лабораторных тестов.Подробный анализ представлен в (Эффективность системы искусственного интеллекта MeDiCase при диагностике инфекции COVID-19 в амбулаторных условиях Проблемы стандартизации в здравоохранении, 2020. 11-12 DOI: https://doi.org/10.26347/1607-2502202011-12027-036 27-36 Воробьев А.П., Воробьев П.А., Муканин Д.А., Краснова Л.С.).
По результатам опроса слабость встречалась в группе 2 в 90,79% случаев, а в группа 3 – в 76,76% случаев, головная боль в группе 2 у 60,53% и у 64,47% в группе 3. Лихорадка была у 64,47% в группе 2 и у 47,03% в группе 3, при этом длительную лихорадку отметили 73,48% респондентов в группе 2 и 55,18% в группе 3. Чувствительность лихорадки к парацетамолу была довольно близка в группе 2 – 63,27% лихорадящих и в группе 3 – 66,66%. «Першение в горле» отмечено у 60,53% респондентов 2-й группы и у 48,65% – 3-й. Кашель отмечен у 44,74% в группе 2 и 35,14% в группе 3, из них более чем у 2/3 респондентов он был сухим, и надсадным – у 70,59% респондентов в группе 2 и 24,62% в группе 3. Ощущение сдавления в грудной клетке было у 65,79% и 48,11% соответственно в группах 2 и 3. Одышку отметили 48,68% в группе 2 и 35,68% – в группе 3, миалгии 64,47% больных из группы 2 и 49,19% – из группы 3. Депрессивное состояние было у 55,26% и 45,95%, наличие суицидальных мыслей – у 42,11% и 30,27% в группах 2 и 3 соответственно. Аносмия с агевзией была у 50% в группе 2 и у 21,62% в группе 3, насморк – у 36,84% и 29,73% соответственно. Необычно яркие сновидения были у в группе 2 у 42,11% и у 20% в группе 3. Боли в животе и диарея встречались у 56,58% в группе 2 и 30,27% в группе 3. Таким образом в группе 2, больные из которой имели безусловную (лабораторно подтвержденную) инфекцию COVID-19, существенно чаще встречались такие симптомы, как слабость, длительная лихорадка, сухой и надсадный кашель, ощущение сдавленности грудной клетки, аносмия и авгезия, яркие сновидения, боли в животе и диарея.
В работе отмечено, что чувствительность методики выявления инфекции COVID19 с применением системы MeDiCase равна 89,5%: система выявляла COVID-19 у 89,5% лиц, имевших позитивный лабораторный ответ на возбудителя.
Образ болезни постковидного синдрома:
Для выявления симптомов у больных были сформулированы вопросы по имеющимся симптомам для автоматизированного древовидного опросника. Формулировки вопросов традиционно для системы MeDiCase [9] были построены таким образом, что ответы на них могли быть только «да» или «нет» Дополнительно в систему были внесены вопросы для выявления депрессивных состояний (на это жаловались многие больные) и решающие правила по выявлению некоторых острых состояний (например – причины кардиалгий или головокружений) из предыдущих версий программы MeDiCase, уже прошедшие валидацию ранее. Некоторые вопросы имели шкалу для оценки путем выбора из предложенного меню (например, при наличии слабости, задавался вопрос о ее выраженности – очень сильная, средней степени и незначительная).
По результатам анализа литературных данных и опроса больных экспертным путем были созданы решающие правила для оценки факта заболевания, ориентировочной степени тяжести и вероятности. Экспертами выступали члены МГНОТ, имеющие опыт работы с данной патологией и другими респираторными инфекциями – 2 профессора, доктора медицинских наук, 2 кандидата медицинских наук.
Опросник рассылался членам групп «Нетипичный коронавирус» в Facebook адресно, по имеющимся у администраторов группы почтовым адресам в октябре-ноябре 2020 г. В анализ было включено ответы 1400 респондентов.
У 51,4% опрошенных был ранее лабораторно подтвержден COVID-19 (ПЦР или наличие антител), 24,6% имели отрицательный результат лабораторного анализа, еще 24% не сдавали лабораторных анализов для подтверждения инфекции.
Самым частым симптомом была слабость – у 80% респондентов, при этом 58,6% – не могли выполнять обычную для себя физическую нагрузку.
Периодическое повышение температуры тела было у 50,8%, 47,1% имели познабливания или ознобы, у 44,9% отмечались ночные поты или потливость днем.
У 50,8% была бессоница, сонливость, нарушение смены дня и ночи, 18,4% отмечают появление необычных и ярких снов, одновременно у 45,2% имелись признаки депрессии, у 43,6% отмечают головные боли.
У 47,1% респондентов было чувство заложенности в груди и нехватки воздуха, у 43% имелись боли в области сердца не стенокардитического характера, у 41,5% были приступы тахикардии, у 30,4% имело место повышение АД, а у 14,9% – понижение АД.
Чуть больше трети (35,1%) жаловались на выпадение волос, 32,9% – на наличие мурашек, жжение кожи, у 19,6% были высыпания на коже, у 18,2% узлы на венах, болезненность вен.
У 28,1% было нарушение зрения, 13,6% – нарушение слуха, 17,9% – нарушения походки.
У 25,4% – респондентов была диарея.
Другие симптомы встречались реже: панические атаки, судороги, полиневропатия, ощущение вибрации в голове и в груди (некоторые образно называли это ощущением трансформатора), сложности с концентрированием внимания, рассеянность, забывчивость, появление «тумана в голове», гинекомастия, нарушения менструального цикла, либидо и других половых функций, головокружение, шум и звон в ушах, синячковость, кровотечения носовые, эмоциональная лабильность, патофагия и патоосмия (отсутсвтуют или преследуют запахи, отвращение к мясу, шоколаду, алкоголю), зубная боль, проблемы с зубами (кистозные изменения в костях челюсти)), аллергические реакции, отеки, лимфостаз, лимфоаденопатия.
С учетом результатов предварительного опроса и результатов ведения больных с постковидным синдромом на базе MeDiCase был сформирован новый, уточненный опросник. Участникам группы было предложено пройти через него для дополнительной валидации опросника. По анализу IP адресов было установлено, что в повторном опросе не принимали участия лица, участвавшие в опросе на первом этапе. Всего в повторном опросе в феврале-марте 2021 г. приняло участие 327 респондентов, 194 анкеты были статистически обработаны. Выбраковка была связана с отрицательным ответом на вопрос «вы отвечали правдиво?» Общая характеристика респондентов: мужчин 21,1%, женщин 78,9%; в возрасте до 18 лет 3,6%, 18-55 лет – 82%, более 55 лет – 14,4%. Давность заболевания составила 1-3 месяца у 44,3%, 3-5 – у 29,4%, более 5 месяцев у 26,3% респондентов. Острый ковид подтвержадался врачом в 62,9%случаев. Сдавали анализы на ковид 82%, из них диагноз подтвержден иммунологически у 87,4%.
По частоте симптомы располагались следующим образом:
- Слабость утомляемость 84,5%
- Боли в мышцах, костях и суставах 63,9%
- Невозможность выполнения обычных нагрузок 60,3%
- Бессоница, сонливость днем 77,3%
· Плохо засыпает 71,3%
· Поверхностный сон 70%
· Часто просыпается 78%
· Имеется сонливость днем 72%
· Просыпается невыспавишийся, разбитым 80%
- Заложенность в груди, проблемы с дыханием 36,6%
- Познабливания 51,5%
- Головные боли появились 43,8%
· Постоянные 24,7%
· Приступообразные 71,8%
- Нарушение регуляции АД 55,2%
· Повышение АД 76,6%
· Понижение АД 37,4%
- Нарушение зрения 40,7%
· Нарушение фокусировки 84,8%
· Снижение остроты зрения 83,5%
· Мелькание перед глазами 44,3%
- Жидкий стул 22,7%
- Высыпания на коже 25,3%
- Из них подобные высыпания бывали ранее у 28,6%
- Стали сниться необычные яркие сны 37,6%
- Узлы на венах, болезненность вен, изменный венозный рисунок 22,7%
· Венозная сеточка на ногах 75%
· Болезненность, жжение по ходу вен 50%
· Узлы или выбухания на венах (аневризмы) 50%
- Нарушение походки 24,2%
- Шум в ушах, нарушение слуха 40,7%
- Боль в области сердца 43,3%
· Боль за грудиной в середине груди 69%
Из них
· Нестерпимая боль 10,3%
· Пронзает спереди назад 25,9%
· Сопровождается холодным потом, слабостью, перебоями, одышкой 62,1%
· Были подобные боли 29,3%
· Боли возникли ночью 19%
· Боль кратковременная, несколько минут 72,4%
· Боль слева от грудины 8,3%
Из них
· Боль усиливается при надавливании на болезненное место 14,3%
· Боли появляются при движении или поворотах 42,9%
· Боль разлитая 22,6%
Из них
· Боли постоянные -10,5%
· Сопровождается слабостью, перебоями, потливостью 21,1%
· Проходят после приема валидола, корвалола 15,8%
- Болит кожа 22,4%
- Потливость ночью или днем 46,9%
- Выпадение волос 41,2%
- Жжение, стягивание кожи 35,1%
- Нарушение потенции, либидо 7,2%
- Похудение 40,7%
· До 5 кг 58,2%
· 5-10 кг 34,2%
· Более, чем на 10 кг 7,6%
- · Головокружения 52,6%
· внезапное головокружение 67,6%
· появилась нарушения походки 58,8%
- Нарушение аппетита 28,4%
- Учащенное мочеиспускание 24,2%
- Увеличение и болезненность лимфоузлов 18,6%
· Лимфоузлы в подчелюстной области на шее 77,8
· В подмышечной области 30,6%
· В паховой области 19,4%
- · Сердцебиния, нарушения ритма 63,4%
· Подргаивают руки 42,3%
- Употребление большого количесвта кофе или чая 13%
- Ощущение неровного ритма сердца 62,6%
· Прием мочегонных препаратов 7,3%
· Ставили диагноз заболевания щитовидной железы 23,6%
· Приступообразный характер 73,2%
- · Депрессия легкая 68,6%
- · Тревога 68,6%
- · Ощущение своей вины перед другими 50,5%
- · Размышление о прошлых ошибках 51,5%
- · Суицидальные мысли 35,5%
- · Мурашки на коже 37,1%
- · Нарушение регуляции температуры тела 47,9%
· повышение 55,9%
· понижение 47,3%
- · Нарушение менструального цикла 27,7% (от женщин)
Наиболее частыми характерными симптомами вирусных инфекций всегда является кожная сыпь (экзантема). Формирование экзантемы предположительно связано с воспалительной реакцией тканей. Основные механизмы развития воспаления: расширение капилляров; стаз крови; повышение сосудистой проницаемости с развитием геморрагий и отека; некроз эпидермиса и дермы; дистрофические изменения клеток; формирование воспаления (Ющук Н. Д. Инфекционные болезни: синдромальная диагностика / под ред. Н. Д. Ющука, Е. А. Климовой – Москва: ГЭОТАР-Медиа, 2017. – 176 с. – ISBN 978-5-9704-4045-2. – Текст: электронный // URL : https://www.rosmedlib.ru/book/ISBN9785970440452.html).
Кожные проявления COVID-19 возможно разделить на 2 группы в зависимости от патофизиологического механизма (Lesort C, Kanitakis J, Villani A et al. COVID‐19 and outbreak of chilblains: are they related? J Eur Acad Dermatol Venereol 2020; 34: e757–e758 DOI: 10.1111/jdv.16779):
– в виде кожной сыпи из-за иммунного ответа на вирусные нуклеотиды.
– вторичные по отношению к системным последствиям, вызванным вирусом (васкулит и тромботические васкулопатии).
Пока нет окончательных суммированных данных о дерматологических проявлениях COVID-19 со всего мира, но есть информация из Китая, Испании, Англии и США. Всего врачи описали более 350 случаев COVID-19 c кожной симптоматикой. Первые исследования из Китая говорили о том, что кожные заболевания у пациентов с COVID-19 встречаются редко. Среди первых 1099 человек, зараженных в Ухане, только у двоих пациентов наблюдались кожные симптомы (0,2%).
Но затем частые поражения кожи заметили у пациентов отделений интенсивной терапии. Сейчас появился специальный онлайн-реестр по дерматологии нового коронавируса, где все страны могут делиться зафиксированными случаями кожных проявлений COVID-19. Его основная цель — быстро и качественно собрать медицинские сведения, которые помогут в лечении.
Поражения кожи и ее придатков при COVID-19 разнообразны (Кожные сыпи при коронавирусной инфекции COVID-19, вызванной SARS-CoV-2. Методические рекомендации N 9. ГБУЗ МНПЦДК ДЗМ, Москва 2021). Они могут появиться за несколько дней до развития инфекции, длительность изменений на коже варьирует от 1 до 14 дней. (Cutaneous manifestations associated with anosmia, ageusia and enteritis in SARS-CoV-2 infection – a possible pattern? Observational study and review of the literature.Birlutiu V, Feiereisz AI, Oprinca G, Dobritoiu S, Rotaru M, Birlutiu RM, Iancu GM.Int J Infect Dis. 2021 Apr 19:S1201-9712(21)00370-2. doi: 10.1016/j.ijid.2021.04.058., Cutaneous Manifestations in Confirmed COVID-19 Patients: A Systematic Review. Conforti C, Dianzani C, Agozzino M, Giuffrida R, Marangi GF, Meo ND, Morariu SH, Persichetti P, Segreto F, Zalaudek I, Neagu N.Biology (Basel). 2020 Dec 5;9(12):449. doi: 10.3390/biology9120449.) Аналогичные высыпания отмечаются при постковидном синдроме и длительно протекающем ковиде. У некоторых пациентов кожные проявления коронавирусной инфекции могут быть единственным проявлением вирусной инфекции. (Skin Manifestations Associated with COVID-19: Current Knowledge and Future Perspectives. Genovese G, Moltrasio C, Berti E, Marzano AV.Dermatology. 2021;237(1):1-12. doi: 10.1159/000512932.)
Выделят 6 основных клинических образов (паттернов/групп) собственно кожных проявлений и 2 – поражения придатков кожи (SARS-CoV-2, COVID-19, skin and immunology – What do we know so far? Novak N, Peng W, Naegeli MC, Galvan C, Kolm-Djamei I, Brüggen C, Cabanillas B, Schmid-Grendelmeier P, Catala A.Allergy. 2021 Mar;76(3):698-713. doi: 10.1111/all.14498.).
Группа 1. Крапивница. В некоторых случаях она может быть даже предвестником начала COVID-19. Также возможно классическое ее развитие вследствие лекарственной непереносимости. Проявляется в виде пятен розового цвета с неровными краями, локализуется преимущественно на конечностях, груди, животе, спине. Может сопровождаться отеком Квинке. Пятна до 15 мм называются розеолы, больше 20 мм – эритема. Обычно это не 1 элемент, а слияние нескольких. Больные могут ощущать сильный зуд или жжение ладоней и подошв, болезненные ощущения при прикосновении и др.
Диффузная алопеция | DermNet NZ
Автор: д-р Харриет Белл, дежурный, Оклендская городская больница, Окленд, Новая Зеландия. Главный редактор DermNet NZ: адъюнкт А / проф. Аманда Окли, дерматолог, Гамильтон, Новая Зеландия. Копия отредактирована Гасом Митчеллом. Октябрь 2019.
Что такое диффузная алопеция?
Алопеция – это медицинское слово, означающее выпадение волос. Алопеция бывает диффузной, если поражает кожу головы в целом. Это контрастирует с локализованной или очаговой алопецией, которая характеризуется неоднородным выпадением волос.
Кто заболевает диффузной алопецией?
Диффузная алопеция встречается часто, поражая до 50% мужчин и женщин. Хотя это может повлиять на оба пола в любом возрасте, женщины обращаются чаще, чем мужчины [1,2].
Волосяной цикл
Волосяные фолликулы проходят через фазы роста и покоя.
- Анаген (фаза роста) длится от двух до шести лет.
- Катаген – это короткая переходная фаза, длится от четырех до шести недель.
- Телоген (фаза покоя) длится два-три месяца и заканчивается высвобождением волос из фолликула [3,4].
Как классифицируется диффузная алопеция?
Диффузную алопецию можно разделить на состояния, вызывающие чрезмерное выпадение волос, и состояния, вызывающие истончение волос [1].
Чрезмерное выпадение волос
Аномальное выпадение волос (или выделение) может происходить во время фазы телогена или анагена цикла волос.
Телогеновое выпадение
Телогеновое выпадение является наиболее частой причиной диффузного выпадения волос [3,5]. Триггерное событие вызывает преждевременное попадание увеличенного количества волос анагена в катаген, а затем в фазу телогена.Чрезмерное выпадение телогеновых волосков происходит через несколько месяцев после триггерного события [3].
Пациенты могут заметить выпадение клочков волос на щетке для волос или во время принятия душа [6]. Может выпадать до 30–50% волос на коже головы [1]. Избыточное выпадение волос может вызвать диффузное истончение, битемпоральную рецессию или выявить характерное выпадение волос у генетически предрасположенных людей [3].
Многие триггеры участвуют в оттоке телогена; К ним относятся:
Телогеновый отток
Выпадение анагена
Отток анагена происходит, когда фаза анагена прерывается, вызывая преждевременное прекращение роста волос и резкое их выпадение.
Истечение анагена чаще всего возникает в результате химиотерапии (см. Лекарственная алопеция) и обычно начинается через одну-две недели после начала лечения. Это может привести к потере 80–90% волос на теле, включая брови и ресницы [1,2]. Это также может быть вызвано отравлением таллием, колхицином или селеном [7].
Истечение анагена также может быть вызвано очаговой алопецией [2]. Гнездная алопеция – это аутоиммунное заболевание у людей с генетической предрасположенностью, которое обычно проявляется в виде очагов выпадения волос с проплешинами (очаговая алопеция) [2,5].Сливающаяся или широко распространенная очаговая алопеция проявляется диффузным выпадением волос, иногда приводящим к полному облысению волосистой части головы (alopecia totalis) или полному облысению тела (alopecia universalis) [1,2,5].
Выделение анагена
Прореживание волос
Постепенное диффузное истончение волос происходит из-за выпадения волос по мужскому или женскому типу [1,8].
Выпадение волос по типу
Выпадение волос по мужскому типу вызвано генетической предрасположенностью, которая влияет на чувствительность волосяных фолликулов к циркулирующим андрогенам; по этой причине ее иногда называют андрогенной алопецией [1,4].Характерный узор – битемпоральная рецессия и облысение в макушке и лобной области.
Выпадение волос по женскому типу имеет сильный генетический компонент, но роль андрогенов неясна [8]. Рисунок истончается на верхней части волосистой части головы с расширением средней части [1,4].
Типичное выпадение волос у женщин происходит раньше и тяжелее при синдроме поликистозных яичников, при вирилизирующей опухоли или при воздействии экзогенного андрогена, такого как тестостерон.
Узор облысения
Каковы осложнения диффузной алопеции?
Выпадение волос оказывает минимальное вредное физическое воздействие; однако это может нанести психологический ущерб и отрицательно сказаться на качестве жизни, поскольку волосы связаны с индивидуальностью человека (см. Психологические последствия выпадения волос).Психиатрические расстройства, включая тревогу и депрессию, чаще встречаются у людей с алопецией, чем у людей без нее [6,9]. Выпадение волос на макушке кожи головы часто приводит к травмам кожи головы, поскольку волосы на коже головы служат ранним предупреждением о надвигающемся контакте.
Как диагностировать диффузную алопецию?
Диффузная алопеция – это клинический признак, наблюдаемый при осмотре. Дополнительные тесты могут использоваться для диагностики основной причины [6].
Анамнез и обследование
Анамнез может выявить триггеры или генетическую предрасположенность [6].Было показано, что женщины точно оценивают процент выпадения волос на основе изменения диаметра или окружности хвоста.
Обследование должно включать:
- Обследование кожи головы должно оценить степень и характер выпадения волос, а также признаки воспаления, покраснения, шелушения и рубцов [2].
- Необходимо оценить длину стержня, диаметр и ломкость стержня волоса [2].
- Обследование кожи головы с помощью дерматоскопа (трихоскопия) может дать дополнительную информацию (см. Дерматоскопия) [4].
- При диффузной алопеции могут наблюдаться изменения ногтей (см. Заболевания ногтей).
- Линии Бо – это бороздка на ногте, совпадающая с моментом остановки роста волос.
- Язвы на ногтях связаны с очаговой алопецией [6].
Анализы крови
Необходимо провести лабораторное обследование для выявления излечимых причин. Это может включать:
- Общий анализ крови и ферритин при анемии и дефиците железа
- Тесты функции щитовидной железы при заболеваниях щитовидной железы
- Уровень цинка в сыворотке крови, поскольку дефицит цинка может быть ранним признаком целиакии
- Функциональные пробы почек и печени
- Антинуклеарные антитела, если признаки указывают на системную красную волчанку
- Гормональная оценка (индекс свободного андрогена, глобулин, связывающий половые гормоны, пролактин) у женщин с клиническими признаками гиперандрогении [2–4,8].
Испытание на вытягивание волос
Испытание на вытягивание волос включает захват 40–60 близко сгруппированных волосков и осторожное вытягивание. Если легко выдергивается более 10% волос, тест положительный [3].
Трихограмма
Для трихограммы выщипывают 20-50 волос и исследуют их под микроскопом, чтобы оценить процентное содержание волос анагена и телогена.
- Нормальный результат – это> 80% волос анагена и <20% волос телогена [4].
- Телогеновый отток характеризуется 25% телогеновых волосков [3].
- Волосы с восклицательным знаком (у которых стержень волоса сужается к коже черепа, имитируя восклицательный знак) типичны для очаговой алопеции [6].
Биопсия кожи головы
Для оценки алопеции следует взять две четырехмиллиметровые пункционные биопсии из макушки черепа или там, где есть клинические признаки [5]. Важно четко обозначить форму запроса на гистологию как предназначенную для исследования алопеции, чтобы можно было разрезать одну биопсию по горизонтали для определения количества фолликулов.
- Повышенное количество телогеновых фолликулов (> 15-25%) без воспаления наблюдается в телогенном эффлювии [3,5].
- Плотный инфильтрат лимфоцитов и других иммунных клеток наблюдается в самой глубокой части волосяных фолликулов при очаговой алопеции [4].
- Миниатюризация волосяных фолликулов (когда фолликулы производят все более тонкие волосы) и низкое соотношение терминальных волос к пушковому волосу наблюдается при облысении по мужскому / женскому типу [2,8].
Каковы методы лечения и исходы диффузной алопеции?
Лечение и прогноз диффузной алопеции зависят от основной причины.
Телогеновый отток
Острый телогеновый отток проходит в течение трех-шести месяцев, а густота волос возвращается к норме, если были выявлены и прекращены прием текущих триггеров или причинных лекарств (см. Лекарственная алопеция) [5]. Однако при генетической предрасположенности может быть остаточная алопеция. Лечение обычно не требуется [6].
Выпадение волос, продолжающееся более шести месяцев, известно как хроническое телогеновое истощение. Она имеет тенденцию колебаться в течение нескольких лет, затем обычно проходит спонтанно [5].
Эфлювий анагена
Выделение анагена контролируют под наблюдением и поддержкой [2].
- Охлаждение кожи головы может уменьшить алопецию, вызванную химиотерапией (см. Кожная токсичность химиотерапевтических препаратов) [10].
- Отфлювий анагена обычно проходит после прекращения химиотерапии; перманентная алопеция встречается редко [6].
Диффузную очаговую алопецию лечить сложно. Даже если лечение вызывает усиление роста волос, выпадение волос может возобновиться после прекращения лечения [1].
Естественное течение диффузной очаговой алопеции непостоянно. Одна треть пациентов выздоравливает самопроизвольно в течение шести месяцев, и у 50–80% этих пациентов через год сохраняются стойкие волосы. У некоторых пациентов могут быть повторные эпизоды диффузной очаговой алопеции [4,9].
Новые отрастающие волосы могут быть не того же цвета или текстуры, которые были до их потери [9].
Прогноз хуже при очаговой алопеции, которая вначале является тяжелой. Менее 10% пациентов с тотальной и универсальной алопецией выздоравливают [1].
Выпадение волос по мужскому и женскому типу
Лечение типичной алопеции следует продолжать бесконечно, поскольку прекращение лечения приводит к повторной потере волос [4,6]. Лечение включает:
- Раствор миноксидила для местного применения – обычно улучшение наблюдается через 6–12 месяцев [4,6]
- Финастерид для перорального применения – применяется при облысении по мужскому типу [4]
- Антиандрогенная терапия для женщин включает пероральный прием спиронолактона, ципротерона ацетата и финастерида, но данные об эффективности ограничены [8].
Накладные волосы и парики, накладные ресницы и брови, а также цветные спреи или макияж могут использоваться для маскировки участков облысения.
Трансплантация волос может использоваться для лечения запущенного облысения по мужскому или женскому типу [4].
Диффузное выпадение волос у взрослой женщины: подход к диагностике и лечению
Телогеновый отток (ТЕ) – наиболее частая причина диффузного выпадения волос у взрослых женщин.TE, наряду с выпадением волос по женскому типу (FPHL) и хроническим телогеном (CTE), составляет большинство случаев диффузной алопеции. Резкое, быстрое и общее выпадение нормальных косолапых волос через 2-3 месяца после инициирующего события, такого как роды, высокая температура, серьезная операция и т. Д., Указывает на TE, в то время как постепенное диффузное выпадение волос с истончением центральной части кожи головы / расширением центральной линии пробора / лобно-височная рецессия указывает на FPHL. Чрезмерное, тревожное диффузное выпадение, исходящее от нормально выглядящей головы с большим количеством волосков и без очевидной причины, является отличительной чертой CTE, который отличается от TE и FPHL.Помимо общего анализа крови и стандартного исследования мочи, уровни ферритина в сыворотке и Т3, Т4 и ТТГ следует проверять во всех случаях диффузного выпадения волос без видимой причины, поскольку дефицит железа и нарушения гормонов щитовидной железы являются двумя часто связанными состояниями. с диффузным выпадением волос, и в большинстве случаев нет очевидных клинических признаков, свидетельствующих о них. CTE часто путают с FPHL, и его можно надежно дифференцировать с помощью биопсии, которая показывает нормальную гистологию CTE и миниатюризацию со значительным снижением соотношения терминальных и пушковых волос (T: V <4: 1) в FPHL.Неоднократная уверенность, поддержка и объяснение того, что состояние представляет собой чрезмерное выпадение, а не фактическую потерю волос, и не приводит к облысению, являются руководящими принципами при лечении TE, а также CTE. TE является самоограничивающимся и разрешается через 3-6 месяцев, если триггер удален или лечится, в то время как прогноз CTE менее определен и может занять 3-10 лет для спонтанного разрешения. Миноксидил 2% для местного применения с антиандрогенами или без них, финестрайд, протезирование волос, косметика для волос и хирургия волос являются терапевтически доступными вариантами для лечения FPHL.
Больничное исследование для определения причин диффузного выпадения волос у женщин
J Clin Diagn Res. 2015 Авг; 9 (8): WC01 – WC04.
1Шашикант Малкуд
1 Старший ординатор, отделение дерматологии, венерологии и лепры, Медицинский колледж ESIC, Калабураги, Карнатака, Индия.
1 Старший ординатор, отделение дерматологии, венерологии и лепры, Медицинский колледж ESIC, Калабураги, Карнатака, Индия.
Автор, ответственный за переписку. ИМЯ, АДРЕС, ИДЕНТИФИКАТОР ЭЛЕКТРОННОЙ ПОЧТЫ АВТОРА-КОРРЕСПОНДЕНТА: Д-р Малкуд Шашикант, старший ординатор, отделение дерматологии, венерологии и лепры, Медицинский колледж ESIC Kalaburagi-585101, Karnataka, India. E-mail: moc.oohay@duklamsПоступило 19 марта 2015 г .; Изменения запрошены 8 апреля 2015 г .; Принято 20 мая 2015 г.
Copyright © 2015 Журнал клинических и диагностических исследований Эта статья цитируется в других статьях PMC.Abstract
Предпосылки
Диффузное выпадение волос – частая жалоба, с которой дерматологи сталкиваются в своей повседневной клинической практике.Выпадение волос у женщин – очень тяжелое состояние. Различные основные факторы по отдельности или в сочетании вносят свой вклад в патогенез.
Цели
Определить причины диффузного выпадения волос у женщин и найти связь между вероятными причинами и соответствующими лабораторными параметрами, где это применимо.
Материалы и методы
В исследование были включены сто восемьдесят женщин с диффузным выпадением волос. Детальный анамнез и клиническое обследование, включая тест на вытягивание волос и микроскопию волос, проводились у всех испытуемых.Были проведены специальные лабораторные исследования для определения железодефицитной анемии, дисфункции щитовидной железы и паразитарной инвазии.
Результаты
Среди 180 пациентов 116 (64,44%) имели телогеновый отток, 28 (15,55%) имели CTE, 21 (11,66%) имели FPHL и 1 (0,55%) имели AE. Четырнадцать пациентов (7,77%) имели более одного этиологического диагноза диффузного выпадения волос. TE был наиболее распространенным типом диффузного выпадения волос. Заболеваемость TE и FPHL была самой высокой в возрастной группе 21-30 лет, тогда как CTE в 30-40 лет.Психологический стресс и железодефицитная анемия были наиболее частыми этиологическими факторами, лежащими в основе ТЕ, что является статистически значимым (p <0,05). Из 130 пациентов с TE более одного этиологического фактора было зарегистрировано в 10 случаях, тогда как в 32 случаях вероятные этиологические факторы не могли быть выявлены из анамнеза. Большинство случаев CTE были идиопатическими. Никакой существенной взаимосвязи между CTE, уровнем гемоглобина и уровнем ферритина в сыворотке не наблюдалось. Из 35 пациентов с FPHL низкий уровень гемоглобина наблюдался у 6/20 (30%) и низкий уровень сывороточного ферритина у 14/17 (82.35%).
Заключение
Диффузное выпадение волос – многофакторное состояние. Подробный анамнез, тщательное клиническое обследование и соответствующие обследования помогают выявить причинные факторы и соответственно лечить их.
Ключевые слова: Анагеновый отток, Хронический телогеновый отток, Выпадение волос по женскому типу, Телогеновый отток.
Введение
Волосы – это эктодермальная структура, имеющая большое косметическое значение. Это помогает человеку поддерживать самооценку и поддерживать здоровые и значимые социальные взаимодействия [1].Выпадение волос вызывает беспокойство у любого человека, независимо от возраста и пола, особенно у женщин [2]. Нормальный цикл роста волос приводит к замене каждого волоса на коже головы к 3-5 годам [3].
Волосы являются неотъемлемой частью идентичности многих женщин. Женственность, сексуальность, привлекательность и индивидуальность символически связаны с волосами женщины, а не с мужчинами. По сравнению с мужчинами из-за выпадения волос у женщин больше вероятность снижения качества жизни и ограничения социальных контактов по сравнению с мужчинами [2]. Психиатрические расстройства более распространены у пациентов с алопецией, чем у населения в целом, что позволяет предположить, что пациенты с алопецией могут иметь более высокий риск развития серьезных депрессивных эпизодов, тревожных расстройств, социальной фобии или параноидального расстройства [1].
Диффузное выпадение волос – частая жалоба дерматологов в их повседневной клинической практике [4]. Женщины обращаются с этой жалобой чаще [5]. Диффузное выпадение волос обычно происходит без воспалений и рубцов [3]. Существуют различные причины диффузного выпадения волос, в том числе выпадение телогена (TE), выпадение волос по женскому типу (FPHL), хроническое выпадение телогена (CTE), выпадение волос в анагене (AE), синдром выпадения волос в анагене и диффузный тип очаговой алопеции. Истинная частота отхождения телогена не определена должным образом из-за отсутствия данных, особенно о субклинических случаях [6–8].Хотя диффузное выпадение волос является распространенной проблемой, в Индии и других странах проведено лишь несколько исследований, изучающих причины диффузного выпадения волос [9,10].
Однако облысение не следует рассматривать только как косметическую жалобу. Это может быть указателем на различные системные заболевания, такие как анемия, гипотиреоз, гипертиреоз, хронические инфекционные заболевания и т. Д. Следовательно, определение причины диффузного выпадения волос обязательно во всех случаях [4]. Это исследование было проведено с целью выявления различных причин диффузной алопеции среди индийских женщин и их связи с соответствующими лабораторными параметрами.
Материалы и методы
Это исследование проводилось на базе больницы в период с октября 2011 года по сентябрь 2013 года. Было проведено предварительное одобрение институционального этического комитета. Были включены все девушки-подростки и женщины, обратившиеся с диффузным выпадением волос в амбулаторное отделение дерматологического отделения третичного лечебного учреждения в течение периода исследования. Пациенты с очаговой / универсальной алопецией и рубцовой алопецией были исключены.
Всего за этот период в исследование было включено 180 пациентов.Пациентам рассказали о неинвазивных методах исследования волос, которые будут использоваться во время исследования. Информированное согласие было получено от всех пациентов или родителей, в случае девочек-подростков. Подробный анамнез был взят у всех субъектов исследования с особыми запросами относительно серьезного лихорадочного заболевания, психологического стресса или любой операции и рождения ребенка в недавнем прошлом (за 3 месяца до начала выпадения волос). Также записывалась история хронической кровопотери, экстренной диеты и приема любых наркотиков.
При общеклиническом обследовании искали специфические признаки анемии, желтухи и отека щитовидной железы. При обследовании кожи головы был отмечен тип выпадения, истончения волос и временная рецессия. Всем пациентам проводились проба на вырывание волос, проба на отрыв и трихоскопия. Пациенты с FPHL были разделены на три подгруппы на основе шкалы Людвига (типы I, II и III). Тест на вытягивание волос проводился путем вытягивания 20-60 волосков между большим, указательным и средним пальцами. Тест считался положительным, если более 10% волос было оторвано от кожи головы [11].У всех пациентов были проведены лабораторные исследования, включая уровень гемоглобина, мазок периферической крови, общий анализ крови, уровень ферритина в сыворотке, тиреотропный гормон (ТТГ), Т3, Т4 и исследование кала.
Наблюдения, относящиеся к параметрам исследуемой группы, выражены в процентах. Собранные данные были представлены со средним значением ± 2SD. Для выявления связи между диффузным выпадением волос и различными лабораторными параметрами применялись критерий хи-квадрат и точный критерий Фишера.
Результаты
Всего за период исследования было обследовано 180 пациентов с диффузным выпадением волос. Из 180 пациентов 116 (64,44%) имели телогеновый отток, 28 (15,55%) имели CTE, 21 (11,66%) имели FPHL и 1 (0,55%) имели AE. Четырнадцать пациентов (7,77%) имели более одного этиологического диагноза диффузного выпадения волос. Различные клинические типы облысения в разных возрастных группах представлены в [].
[Таблица / Рис-1]:
Клинические типы облысения среди различных возрастных групп пациентов
| Клинические типы | Возрастные группы в годах | |||||
|---|---|---|---|---|---|---|
| 10-20 | 21-30 | 31-40 | 41-50 | 51-60 | Всего | |
| TE | 24 | 62 | 23 | 5 | 2 | 116 | CTE | 6 | 7 | 13 | 2 | 0 | 28 |
| FPHL | 1 | 7 | 6 | 5 | 2 | 21 |
| 0301 | 1 | 0 | 0 | 01 | ||
| TE + FPHL | 0 | 6 | 4 | 3 | 1 | 14 |
| Всего | 903 01 | 180 | ||||
Возраст пациентов с ТЭ варьировал от 12 до 54 лет (средний возраст 25 лет.9 ± 7,99 года). Заболеваемость TE была самой высокой в возрастной группе 21-30 лет. Продолжительность выпадения волос составляет от 7 дней до 6 месяцев. Психологический стресс был наиболее частым вероятным этиологическим фактором (n = 48, p <0,05), за которым следовало предшествующее лихорадочное заболевание в 16 случаях, прием лекарств в 12 случаях, местное применение различных коммерческих продуктов для волос в 8 случаях, экстренная диета в 8 случаях, ребенок роды в 7 случаях, хроническая кровопотеря в 6 случаях, предшествующая операция в 3 случаях []. На основании анамнеза невозможно выявить вероятный этиологический фактор у 32 (24.61%) пациентов и более одного фактора зафиксировано в 10 (7,69%) случаях. При осмотре кожи головы истончение волос было выявлено у 46 (35,38%) пациентов. Проба на вырывание волос была положительной у 54 (41,53%) пациентов. Положительный тяговой тест и битемпоральная рецессия наблюдались у 13 (10%) и 16 (12,30%) пациентов соответственно. Волосы телогена при микроскопическом исследовании наблюдались у всех пациентов (100%).
[Таблица / Рис. 2]:
Вероятные этиологические причины отхождения телогена у исследуемых субъектов (на основе анамнеза)
| Sl.№ | Возможные этиологические причины | Кол-во пациентов | % | |||||
|---|---|---|---|---|---|---|---|---|
| 1 | Фебрильное заболевание | 16 | 12.30 | |||||
| 2 | 36300 | 9027 3 | Рождение ребенка | 7 | 5,38 | |||
| 4 | Экстренная диета | 8 | 6,15 | |||||
| 5 | Хирургическая операция | 3 | 2.30 | |||||
| 6 | Хроническая кровопотеря | 6 | 4,61 | |||||
| 7 | Прием наркотиков | 12 | 9,23 | |||||
| 8 | Актуальное применение | 6,18 |
Полная гемограмма была сделана 83 из 130 пациентов. Низкий уровень гемоглобина (<12 г / дл) наблюдался у 50/83 (60,24%) пациентов (p <0,05). При исследовании периферического мазка микроскопический гипохромный мазок выявлен у 21/83 (25.30%) пациентов, нормоцитарный гипохромный мазок у 4/83 (4,87%) пациентов, диморфная и макроцитарная анемия у каждого 1/83 (1,21%) пациента []. Уровень ферритина в сыворотке крови определялся у 74 из 130 пациентов с ТЭ. Уровень ферритина в сыворотке <70 мкг / л наблюдался у 69/74 (93,24%) пациентов (p> 0,05) []. Функциональный тест щитовидной железы был проведен 74 из 130 пациентов с ТЕ; гипертиреоз был зарегистрирован у 3/74 (4,05%) пациентов, а субклинический гипотиреоз – у 2/74 (2,70%) пациентов. Обследование кала проведено 33 пациентам; Признаки паразитарной инвазии наблюдались у 2 (6.06%) пациентов.
[Таблица / Рис-3]:
Уровень гемоглобина и результаты мазка периферической крови у пациентов с оттоком телогена, хроническим оттоком телогена и выпадением волос по женскому типу (MCHC-микроцитарная гипохромная, NCHC-нормоцитарная гипохромная, MC-макроцитарная анемия, DM – диморфная анемия, NCNC- нормоцитарная нормохромная)
| Диагноз | Уровень гемоглобина (г / м%) | Мазок периферической крови | |||||
|---|---|---|---|---|---|---|---|
| <12 | > 12 9027C | MC | NCNC | ||||
| TE (n = 83) | 50 (60.2%) | 33 (39,7%) | 21 | 4 | 1 | 1 | 56 |
| FPHL (n = 20) | 6 (30%) | 14 (70%) | 2 | 2 | – | – | 16 |
| CTE (n = 20) | 10 (50%) | 10 (50%) | 5 | 2 | – | – | 13 |
[Таблица / Рис.-4]:
Уровень ферритина в сыворотке у пациентов с телогеновым выпадением, выпадением волос по женскому типу и хроническим телогеновым оттоком
| Диагноз | Уровень | сыворотки ферритина <12 мкг / л | 12-20 мкг / л | 20-70 мкг / л | > 70 мкг / л | |||
|---|---|---|---|---|---|---|---|---|
| TE (n = 74) | 25 (33.78%) | 17 (22,97%) | 27 (34,48%) | 5 (6,75%) | ||||
| FPHL (n = 17) | 5 (29,41%) | 3 (17,64%) | 6 (35,29%) | 3 (17,64%) | ||||
| CTE (n = 17) | 2 (11,76%) | 2 (11,76%) | 8 (47,05%) | 5 (29,41%) | ||||
Всего 35 пациентов были диагностированы как FPHL. Возраст начала облысения по женскому типу варьировал от 20 до 55 лет. Возраст пациента с FPHL I типа варьировал от 20 до 55 лет (средний возраст 28 лет.87 ± 8,81 года), а возрастной диапазон пациентов с FPHL типа II составлял от 22 до 55 лет (средний возраст 36,75 ± 8,60 лет), но ни у одного из них не было FPHL типа III. В семейном анамнезе узорчатое облысение отмечено у 14 (38,8%) пациентов. Заболеваемость FPHL была самой высокой в возрастной группе от 21 до 30 лет. При обследовании битемпоральная рецессия отмечена у 3 (8,33%) пациентов. Положительный результат теста на выдергивание волос наблюдался у 13 (36,11%) пациентов. При микроскопическом исследовании телогеновые волосы были обнаружены у всех пациентов (100%).
Полная гемограмма была сделана 20 из 35 пациентов.Низкий уровень гемоглобина отмечен у 6/20 (30%) пациентов (p <0,05). Исследование мазка периферической крови показало гипохромную микроцитарную и нормоцитарную гипохромную картину у 2 (10%) пациентов []. У 17 из 35 пациентов была проведена оценка уровня ферритина в сыворотке крови. Уровень сывороточного ферритина <70 мкг / л наблюдался в 14 случаях (p> 0,05) []. Функциональный тест щитовидной железы был проведен у 17 из 35 пациентов. Биохимические признаки субклинического гипотиреоза и гипертиреоза зарегистрированы у 1 пациента.
Среди 180 пациентов с диффузным выпадением волос 28 (15.55%) пациенты были диагностированы как CTE с возрастом пациентов от 15 до 45 лет (средний возраст 26,74 года). Заболеваемость CTE была самой высокой в возрастной группе 30-40 лет. Из 28 пациентов с ХТР 5 сообщили в анамнезе о возможных этиологических причинах ХТР. Это были прием лекарств (n = 1, 3,57%), диабет (n = 2, 7,14%), белковая энергетическая недостаточность (n = 1, 3,57%) и дефицит цинка (n = 1, 3,57%).
При осмотре кожи головы истончение волос было отмечено у 5 (17,8%) пациентов, а рецессия битемпорала – у 5 (17.85%) пациентов. Проба на вырывание волос была положительной у 10 (35,71%) пациентов. Полная гемограмма была сделана 20 из 28 пациентов; низкий уровень гемоглобина (<12 г / дл) наблюдался у 10 пациентов (p> 0,05). При исследовании мазка периферической крови микроцитарная гипохромная анемия была выявлена у 5 пациентов, а нормоцитарная гипохромная анемия – у 2 пациентов []. Уровень ферритина в сыворотке крови был оценен у 17 из 28 пациентов. Уровень ферритина в сыворотке <70 мкг / л наблюдался в 12 случаях (p> 0,05) []. Функциональный тест щитовидной железы был проведен у 17 из 28 пациентов, но все они оказались эутиреоидными.Один из 180 пациентов поступил с НЯ. Она получала химиотерапию (циклофосфамид, адриамицин, 5-флуроурацил) по поводу рака груди. При осмотре тест на выдергивание волос и тест на перетягивание дали положительные результаты. При микроскопическом исследовании наблюдались дистрофические волосы анагена.
Обсуждение
Дерматологи часто сталкиваются с проблемами волос в повседневной практике. Выпадение волос практически не имеет вредных для здоровья последствий или вообще не имеет, но может привести к психологическим последствиям, включая высокий уровень беспокойства и депрессии [12].Выпадение волос – распространенное заболевание, распространенность которого оценивается в 1,7% в течение всей жизни; однако эта цифра не является надежной оценкой, так как по этому поводу опубликовано очень мало эпидемиологических исследований, отчасти из-за занижения данных [1].
Связь низкого уровня ферритина в сыворотке и выпадения волос обсуждалась на протяжении многих лет. Существуют разногласия по поводу порогового уровня сывороточного ферритина, ниже которого его можно определить как дефицит питательных веществ, вызывающий выпадение волос [13]. Ферритин сыворотки напрямую связан с внутриклеточным ферритином и, следовательно, с общими запасами железа в организме.Только дефицит железа вызывает очень низкие концентрации ферритина в сыворотке; поэтому низкая концентрация ферритина очень специфична для дефицита железа [14].
Используя уровень ферритина в сыворотке в качестве маркера дефицита накопления железа, определение дефицита железа (но не конкретно железодефицитной анемии) в различных исследованиях варьировалось от уровня ферритина в сыворотке от ≤15 мкг / л до <70 мкг / л. По данным Всемирной организации здравоохранения (ВОЗ), анемия определяется как уровень сывороточного гемоглобина <12 г / дл [15].
Telogen effluvium
Из 180 пациентов 116 были диагностированы как TE и 14 были TE с FPHL []. Jain et al. Изучили 100 случаев диффузного выпадения волос и наблюдали TE в 92% случаев; лихорадочное заболевание было наиболее частой причиной (33%) [9]. В настоящем исследовании психологический стресс был наиболее частой причиной ТЕ (36,92%), и между этими двумя переменными была статистически значимая связь (p <0,05). Rustom et al. Изучили 50 случаев TE и также обнаружили, что психологический стресс был наиболее частой первопричиной (42%) [10].В их исследовании низкий уровень гемоглобина был зарегистрирован в 50% случаев с ТЕ [10]; в настоящем исследовании он был обнаружен у 60,24% пациентов, и между этими двумя переменными была статистически значимая связь (p <0,05). При обычном осмотре кала паразитарная инвазия желудочно-кишечного тракта была обнаружена в 12 случаях в вышеупомянутом исследовании [10]. В настоящем исследовании паразитарные инвазии наблюдались в 2 случаях. Авторы не указали сопутствующий прием лекарств или эндокринопатию как этиологический фактор ТЕ, тогда как в настоящем исследовании прием лекарств, гипертиреоз и гипотиреоз встречались как вероятные причины телогенного истощения у 9 пациентов.23%, 4,05% и 2,70% случаев соответственно. Основываясь на анамнезе, Rustom et al. Не смогли найти никаких вероятных этиологических причин диффузного выпадения волос у 30% пациентов [10]; по сравнению с настоящим исследованием, где у 24,61% пациентов не было анамнеза, относящегося к вероятным причинам ТЕ.
Случай телогенного истощения с полным наложением выпавших волос
В проспективном когортном исследовании, проведенном Sinclair R, у 194 женщин в возрасте от 11 до 72 лет с TE у 12 (6%) был обнаружен уровень ферритина в сыворотке ≤ 20 мкг / л [13].У всех этих пациентов концентрация гемоглобина была нормальной [13]. В настоящем исследовании уровень ферритина в сыворотке <70 мкг / л наблюдался у 69 из 74 пациентов, что было статистически недостоверным (p> 0,05). Kantor et al. Сравнили уровень ферритина в сыворотке у пациенток с выпадением волос различной этиологии, например, телогеновой алопецией, андрогенной алопецией, гнездной алопецией и тотальной / универсальной алопецией, со здоровой контрольной группой [16]. Средние уровни ферритина в сыворотке были ниже у субъектов с андрогенетической алопецией и очаговой алопецией по сравнению со здоровыми контрольными субъектами, но не так по сравнению с пациентами с TE или алопецией totalis / universalis [16].
Выпадение волос по женскому типу
Менее 45% женщин всю жизнь имеют волосы на голове [2]. FPHL характеризуется уменьшением густоты волос на макушке и лобной части головы с сохранением передней линии волос. Распространенность FPHL увеличивается с возрастом. Пострадавшие женщины могут испытывать психологический стресс и нарушение социального взаимодействия. В большинстве случаев диагноз может быть поставлен клинически и возможно лечение.
Из 180 пациентов 21 был диагностирован как FPHL, а у 14 был FPHL с TE.Среди них 15 пациентов имели тип I и 20 пациентов – FPHL типа II. Gan et al. Отметили увеличение распространенности FPHL с возрастом, примерно с 12% среди женщин в возрасте от 20 до 29 лет до более 50% среди женщин старше 80 лет [17]. В исследовании Birch et al., В котором участвовали 337 женщин в возрасте 18–99 лет, которые обратились в клинику общей дерматологии с другими жалобами, у 6% женщин в возрасте до 50 лет был диагностирован FPHL [18]. Заболеваемость увеличилась до 38% у женщин старше 70 лет [18].В отличие от вышеупомянутых исследований, настоящее исследование регистрирует более низкую частоту FPHL в старшей возрастной группе. Это может быть связано со снижением обеспокоенности по поводу выпадения волос в старшей возрастной группе этой группы населения, которая в основном проживает в сельской местности. Средний возраст начала FPHL в нашем исследовании составлял 31,60 года по сравнению с 34,4 года, сообщенными Zhang et al. [19]. FPHL типа III или степени 5 по Синклеру является тяжелой формой, которая встречается редко и поражает менее 1% женщин [2]. В нашем исследовании мы не зарегистрировали ни одного случая FPHL типа III.В исследовании с участием 60 пациенток с узорным облысением семейный анамнез андрогенетической алопеции среди мужчин присутствовал у 27/60 (45%) пациентов [19]; В настоящем исследовании такой анамнез отмечен у 14 из 35 (38,8%) пациентов. Средняя продолжительность выпадения волос у наших пациентов составила 1,5 года по сравнению с 4,49 года в другом исследовании [19].
Низкий уровень гемоглобина (<12 г / дл) был зарегистрирован у 6/20 (30%) пациентов в настоящем исследовании по сравнению с 8,3% в другом исследовании [19]. Только 2/20 пациентов показали микроскопический гипохромный мазок периферической крови в настоящем исследовании.Из 17 пациентов у 2 была дисфункция щитовидной железы, из которых у одного был субклинический гипотиреоз, а у другого - гипертиреоз. В исследовании Zhang et al. Из 17 пациентов с FPHL небольшое отклонение уровня ТТГ было зарегистрировано у 2 (11,76%) пациентов, но уровни T3, T4 были в пределах нормы [19].
В этом исследовании пациенты были разделены на 4 группы в зависимости от уровня ферритина в сыворотке крови:
<12 мкг / л (дефицит железа)
12-20 мкг / л (истощение запасов железа)
20- 70 мкг / л (уровень ферритина в сыворотке ниже, чем требуется для нормального цикла волос)
> 70 мкг / л (нормальный уровень ферритина)
Уровни ферритина в сыворотке были оценены у 17 из 35 пациентов с FPHL.У четырнадцати (82,35%) из этих 17 пациентов уровень ферритина в сыворотке был <70 мкг / л. Это выше по сравнению с результатами исследования Zhang et al. [19], где только у 35% пациентов с FPHL уровень ферритина в сыворотке был <70 мкг / л. В нашем исследовании мы не обнаружили значительной связи между FPHL и уровнем ферритина в сыворотке. Это похоже на результаты исследования Zhang et al. [19]. Olsen et al. Изучили 285 женщин с FPHL, из которых 215 (75,4%) показали уровень ферритина в сыворотке <70 мкг / л [14] по сравнению с 82.35% в нашем исследовании. Средний уровень гемоглобина и ферритина в сыворотке составлял 11,2 г / дл и 36,11 мкг / л соответственно по сравнению со значениями 13,64 г / дл и 61,01 мкг / л в исследовании Olsen et al. [14].
В другом исследовании «случай-контроль», проведенном Aydingoz et al., Авторы сравнили 10 женщин с FPHL и 46 здоровых людей из контрольной группы [20]. Не было различий в распространенности истощенных запасов железа или железодефицитной анемии в обеих группах.
Хронический телогеновый отток
ХТР – это диффузная генерализованная форма облысения неизвестной причины, которая часто встречается у женщин среднего возраста.Он поражает всю кожу головы, часто начинается внезапно и вызывает тревогу у пациента из-за выпадения большого количества волосков [21]. В настоящем исследовании из 180 пациентов с диффузным выпадением волос у 28 был диагностирован КТР. Продолжительность облысения у этих пациентов варьировала от 6 месяцев до 8 лет. Заболеваемость CTE была самой высокой в возрастной группе 31-40 (46,42%) лет. Чаще всего страдали женщины в пременопаузе (96,4%), в отличие от исследования Гарсиа-Эрнандес, в котором это преимущественно наблюдалось у женщин в постменопаузе (67%) [21].Olsen et al. Изучили 96 женщин с CTE, из которых 58 (60%) находились в пременопаузе, а 38 (40%) – в постменопаузе [14].
В этом исследовании вероятными этиологическими причинами CTE, основанными на анамнезе, были прием лекарств у 1 (3,57%) пациента, диабет у 2 (7,14%) пациентов, белковая энергетическая недостаточность у 1 (3,57%) пациента и дефицит цинка у 1 (3,57%) пациент. При осмотре кожи головы истончение волос было отмечено у 5 (17,8%) пациентов, битемпоральная рецессия – у 5 (17,85%) пациентов, проба на вырывание волос была положительной у 10 (35.71%) пациентов.
Из 28 пациентов с ХТР в этом исследовании 20 прошли оценку гемоглобина, и у 10 (50%) из них был обнаружен низкий уровень (<12 г / дл), который не был статистически значимым (p> 0,05). Уровень ферритина в сыворотке был оценен у 17 пациентов, и у 15 пациентов уровень ферритина в сыворотке был <70 мкг / л, что было статистически недостоверным (p> 0,05). В исследовании Olsen et al. [14] 72 из 96 (75%) пациентов имели уровень ферритина в сыворотке <70 мкг / л по сравнению с 88,23% пациентов в нашем исследовании.Средний уровень ферритина в сыворотке у пациентов с ХТР в нашем исследовании составлял 39,39 мкг / л по сравнению с 51,81 мкг / л в исследовании Olsen et al. [14]. Раштон и др. Изучили 200 женщин с ХТР, из которых 95% имели уровень ферритина в сыворотке менее 70 мкг / л [22]. Профиль щитовидной железы был также выполнен у 17 из 28 пациентов в нашем исследовании и не показал отклонений от нормы.
Анагеновый отток
При НЯ выпадение волос обычно начинается через 1-3 недели после начала химиотерапии. Степень выпадения волос зависит от пути, а также от дозы и частоты приема лекарств.Из-за длительной фазы анагена кожа головы является наиболее частым местом выпадения волос, в то время как другие терминальные волосы страдают по-разному в зависимости от процента волос в фазе анагена. АЭ обычно обратимы [23].
Из 180 пациентов только у одного была диагностирована НЯ []. Пациентка была начата с циклофосфамида, адриамицина и 5-флуроурацила по поводу рака груди. Через 3 недели после начала химиотерапии она заметила выпадение волос. При осмотре кожи головы выявлено диффузное выпадение волос.При микроскопическом исследовании наблюдались дистрофические волосы анагена []. Критерии Всемирной организации здравоохранения для анагена: степень 0 = отсутствие выпадения, степень 1 = умеренное выпадение волос и степень 2 = выраженное или полное выпадение волос. Согласно критериям ВОЗ, данный случай относился ко второй степени [23].
Случай анагенного выпадения через 3 недели после начала химиотерапии карциномы груди
Микрофотография, показывающая выпадение волос анагена (10X), в случае анагенного выпадения
Заключение
Распространенным клиническим состоянием является диффузное выпадение волос.Диагноз может быть установлен на основании анамнеза, с особым акцентом на хронологию событий, осмотра выпавших луковиц и нескольких простых скрининговых лабораторных тестов. После установления диагноза соответствующее лечение в соответствии с диагнозом может остановить выпадение волос во всех случаях, кроме CTE. Однако пациенты с CTE могут быть уверены, что состояние не прогрессирует и самоограничивается.
Примечания
Финансовые или другие конкурирующие интересы
Нет.
Список литературы
[3] Habif TP. Клиническая дерматология: цветной справочник по диагностике и терапии. 5 изд. Сент-Луис: Мосби; 2010. Болезни волос. В: Хабиф Т.П., редактор; С. 920–22. [Google Scholar] [4] Wadhwa SL, Khopkar U, Nischal KC. IADVL Учебник дерматологии. 3-е изд. Мумбаи: издательство Bhalani Publishing House; 2010. Заболевания волос и кожи головы. В: Валия Р.Г., Валия А.Р., редакторы; С. 864–948. [Google Scholar] [6] Grover C, Khurana A. Telogen effluvium. Индийский J Dermatol Venereol Leprol. 2013; 79: 591–603.[PubMed] [Google Scholar] [7] Харрисон С., Синклер Р. Телогеновое истощение. Clin Exp Dermatol. 2002. 27: 389–85. [PubMed] [Google Scholar] [8] Синклер Р.Д., Банфилд С.К., Даубер Р.П. Справочник болезней волос и кожи головы. Великобритания: Blackwell Science Ltd; 1999. Диффузное выпадение волос. В: Sinclair RD, Banfield CC, редакторы Dawber RP; С. 64–74. [Google Scholar] [9] Джайн В.К., Катария У., Дайал С. Исследование диффузной алопеции у женщин. Индийский J Dermatol Venereol Leprol. 2000. 66: 65–68. [PubMed] [Google Scholar] [10] Rustom A, Pasricha JS.Причины диффузного облысения у женщин. Индийский J Dermatol Venereol Leprol. 1994; 60: 266–71. [Google Scholar] [12] Шривастава С.Б. Диффузное выпадение волос у взрослых женщин: подход к диагностике и лечению. Индийский J Dermatol Venereol Leprol. 2009. 75: 20–28. [PubMed] [Google Scholar] [13] Sinclair R. Нет четкой связи между низким уровнем ферритина в сыворотке и хроническим диффузным телогеном выпадения волос. Br J Dermatol. 2002. 147: 982–84. [PubMed] [Google Scholar] [14] Olsen EA, Reed KB, Cacchio PB, Caudill L. Дефицит железа при облысении по женскому типу, хроническое отток телогенов и контрольные группы.J Am Acad Dermatol. 2010; 63: 991–99. [PubMed] [Google Scholar][15] Всемирная организация здравоохранения. Железодефицитная анемия: оценка, профилактика и контроль. Гевева: ВОЗ; 2001.
[16] Kantor J, Kessler LJ, Brooks DG, Cotsarelis G. Снижение сывороточного ферритина связано с алопецией у женщин. J Invest Dermatol. 2003. 121: 985–88. [PubMed] [Google Scholar] [17] Ган Д.К., Синклер Р.Д. Распространенность облысения по мужскому и женскому типу в Мэриборо. J Investigate Dermatol Symp Proc. 2005; 10: 184–89. [PubMed] [Google Scholar] [18] Берч член парламента, Messenger JF, Messenger AG.Плотность, диаметр волос и распространенность облысения по женскому типу. Br J Dermatol. 2001; 144: 297–304. [PubMed] [Google Scholar] [19] Чжан X, Caulloo S, Zhao Y, Zhang B, Cai Z, Yang J. Выпадение волос по женскому типу: клинико-лабораторные данные и трихоскопия в зависимости от тяжести заболевания. Int J Trichology. 2012; 4: 23–28. [Бесплатная статья PMC] [PubMed] [Google Scholar] [20] Айдингоз И., Ферханоглу Б., Гуней О. Имеет ли значение содержание железа в тканях при облысении у женщин? J Eur Acad Dermatol Venereol. 1999; 13: 65–67.[PubMed] [Google Scholar] [21] Гарсия-Эрнандес MJ, Camacho FM. Хронический телогеновый отток: частота возникновения, клинико-биохимические особенности и лечение. Arch Dermatol. 1999: 135, 1123–24. [PubMed] [Google Scholar] [22] Раштон Д.Х., Норрис М.Дж., Довер Р., Бусутти Н. Причины выпадения волос и достижения в области омоложения волос. Int J Cosmet Sci. 2002; 24: 17–23. [PubMed] [Google Scholar] [23] Таллон Б., Бланшар Э., Голдберг Л.Дж. Постоянная алопеция, вызванная химиотерапией: описание случая и обзор литературы.J Am Acad Dermatol. 2010; 63: 333–36. [PubMed] [Google Scholar]Введение
ВведениеГомеостаз кожи – это сложный процесс, в котором эпидермальные стволовые клетки (SC) самообновляются и генерируют дочерние клетки, которые пролиферируют, подвергаются терминальной дифференцировке и в конечном итоге умирают. Среди генов, регулирующих эпидермальный гомеостаз, мы ранее описали роль гена Tcl1a на мышиной модели [1]. TCL1A был первоначально выделен как онкоген, участвующий в T-PLL человека, и широко изучается на B-CLL [2-8], хотя у мышей Tcl1 – / – обнаруживается легкое нарушение дифференцировки B- и T-клеток [9]. .Сверхэкспрессия TCL1A при раке или на моделях мышей тесно связана с условиями пролиферации / выживания [10–12]. Кроме того, TCL1 влияет на баланс пролиферации / дифференцировки, способность к самообновлению и плюрипотентность эмбриональных стволовых клеток мыши (ESC) [13–18], и он высоко экспрессируется в предимплантационном эмбрионе, позволяя прогрессировать за пределы 4-клеточной стадии. [19, 20].
В нашем предыдущем исследовании мы показали, что TCL1 влияет как на рост волос, так и на целостность эпидермиса [1].Мы обнаружили, что потеря Tcl1a привела к нарушению пролиферации транзиторных амплифицирующих (ТА) клеток в фазе регенерации волосяного фолликула и к отсутствию экспрессии SC-маркера CD34 в выпуклости (т. Е. В SC-нише), что повлияло на способность включать BrdU в SC с медленным циклом и в клетки TA. Кроме того, было обнаружено, что Tcl1a экспрессируется в базальном слое эпидермиса мыши, где его потеря вызывает дисбаланс дифференцировки / пролиферации, что приводит к аберрантной совместной экспрессии маркеров пролиферации и апоптоза в одной и той же клетке.Как следствие, у взрослых мышей Tcl1 – / – развиваются дефекты кожи, представленные ранней алопецией и поздними изъязвлениями. Интересно, что мутантный фенотип почти полностью устраняется сверхэкспрессией TCL1A, управляемой эпидермальным промотором K14, in vivo [1].
TCL1, как известно, усиливает фосфорилирование AKT Ser-473 и его ядерную транслокацию как у людей, так и у мышей [21-24]. Кроме того, TCL1 действует как активатор NFkB через взаимодействие с p300 и как ингибитор AP1-зависимой транскрипции через прямое взаимодействие с cFOS и cJUN [25].
В этом исследовании мы использовали анализ профиля экспрессии генов (GEP), чтобы раскрыть пути, на которые влияет потеря функции Tcl1a в эпидермальных кератиноцитах (KCs), сравнивая модели Tcl1 – / – и мыши WT. Кроме того, мы оценили реактивацию TCL1 в базальном слое эпидермиса на мышиной модели K14-TCL1 на предмет его способности спасать аберрантный фенотип как на молекулярном, так и на функциональном уровнях. Мы особенно сосредоточились на функциях пролиферации / дифференцировки / апоптоза, и наши результаты показывают, что TCL1 влияет на несколько путей, индуцированных фактором роста, в результате чего путь RAS-MAPK сильно задействован.В частности, мы обнаружили, что TCL1 важен для индуцированной IGF1 пролиферации первичных KC и для их клоногенной способности. Кроме того, расщепление белков, связанных с апоптозом, таких как каспаза 3 (CASP3) и поли (АДФ-рибоза) полимераза 1 (PARP1), увеличивается в Tcl1 – / – KC. Также описаны изменения в паттерне экспрессии маркеров дифференцировки, таких как KRT6, FLG и IVL. Интересно, что восстановление экспрессии TCL1A в модели мышей K14-TCL1 почти полностью меняет аберрантный фенотип.
Материалы и методы. Исследовали животныхмышей дикого типа C57bl / 6 (WT), Tcl1 – / – и K14-TCL1; Tcl1 – / – (K14-TCL1) [1]. Все экспериментальные процедуры, уход за животными и условия содержания соответствовали европейским (Директива 86/609 / ECC и 2010/63 / UE) и итальянским (DL 116/92 и DL 26/2014) законам об использовании животных в научных исследованиях. одобрен Комитетом по уходу и использованию животных IDI-IRCCS «Organismo Preposto al Benessere Animale» (OPBA), а протокол был одобрен Министерством здравоохранения Италии.Были приложены все усилия, чтобы минимизировать страдания.
Выделение РНКДля экспериментов по экспрессии генов собирали участки кожи размером 1 см 2 через три дня после депиляции (3dpd). Биопсию кожи вырезали и помещали в PBS, содержащий 1 ед. / Мл диспазы (BD Biosciences, Бельгия), и инкубировали в течение ночи при 4 ° C при небольших колебаниях. Затем эпидермальный лист отделяли от дермы стерильным пинцетом и помещали в 1 мл реагента ТРИЗОЛ (Life Technologies, Великобритания). Тотальную РНК экстрагировали в соответствии с протоколом производителя.Качество РНК проверяли с помощью агарозного геля, и количественное определение производили с помощью спектрофотометра NanoDrop (Thermo Fisher Scientific, Массачусетс, США).
Профиль экспрессии микроматрицыБыли приготовлены биотинилированные кРНК-зонды и гибридизованы с пангеномными матрицами Affymetrix Mouse Genome 430 2.0 в соответствии с протоколом производителя (Affymetrix, Санта-Клара, Калифорния, США). Для каждого генотипа использовали три животных и три независимых чипа. Неконтролируемый иерархический анализ проводился с использованием программного обеспечения BRB-Array Tools (Отдел биометрических исследований, Национальный институт рака) [26] и программного обеспечения Partek Genomic Suites (Partek Inc.Сент-Луис, Миссури, США) для анализа главных компонент (PCA). Для идентификации генов, которые по-разному экспрессировались в группах WT, Tcl1 – / – и K14-TCL1, был проведен контролируемый анализ с использованием «инструментов сравнения классов» инструментов набора BRB. К отфильтрованным наборам данных применялась модель случайной дисперсии. Гены со значениями p менее 0,001 считались статистически значимыми. Более того, гены были исключены, если их экспрессия была менее чем в 1,4 раза ниже медианного значения гена, по крайней мере, в 20% образцов.Уровень ложных открытий (FDR) также оценивался для каждого гена с использованием метода Бенджамини и Хохберга для контроля ложноположительных результатов [27]. Онтология генов (GO) и анализ путей использовали двухвыборочные t-тесты и модель случайной дисперсии. Значимые наборы генов были обнаружены с помощью теста перестановки LS / KS и теста GSA maxmean Эфрона-Тибширани. Для категорий генов, идентифицированных GO, порог был P <0,005. Для анализа путей порог определения значимых наборов генов был P <0,05. Наборы генов определены в Biocarta Pathway (https: // cgap.nci.nih.gov/Pathways/BioCarta). Анализ путей и GO был выполнен с использованием инструмента «Сравнение экспрессии набора генов» инструментов набора BRB. Согласно политике доступности данных PLOS, данные микрочипов депонируются в GEO (инвентарный номер GSE118345).
ПЦР в реальном времениКоличественное определение целевых мРНК в реальном времени относительно мРНК РНК-полимеразы II (RPII) проводили с помощью набора SYBR Green 2X SensiMix One-Step Kits (Quantace, Великобритания) с использованием системы обнаружения ABI PRISM 7000 (Applied Biosystems, Великобритания). .кДНК получали с использованием 1 мкг общей РНК, 0,5 мкг олиго dT, 1 мкл обратной транскриптазы ImProm-II (Promega, WI, США). 3 мкл кДНК, разведенной 1: 7, добавляли в 25 мкл общей реакционной смеси. Праймеры для генов-мишеней (Krt6; cFos; Gjb2; Dio2; Dusp1; Epgn; Rptn; S100a9; Sprr1b; Stk25) и эталонного гена (RPII) (MWG, Biotech, Германия) были оптимизированы для конечной концентрации 50 нМ и перечислены в Таблица S1. Был использован следующий протокол экспериментального запуска: начальная денатурация 95 ° C в течение 10 минут, затем 40 циклов денатурации 95 ° C в течение 15 секунд и отжиг при 60 ° C в течение 1 минуты.Продукты RT-PCR, проанализированные с помощью гель-электрофореза, дали один продукт ожидаемой длины. Кроме того, был проведен анализ кривой плавления, который подтвердил специфичность реакции и отсутствие димеров праймеров. Относительную экспрессию генов определяли количественно, как описано в Пользовательском бюллетене № 2 для ABI PRISM 7000.
Культура клетокKC мышей выделяли из кожи новорожденных мышей, как описано [28], за исключением того, что эпидермис диссоциировал после добавления 0,05% ДНКазы (Sigma-Aldrich, Италия).5 клеток в 5 мл среды.
Анализ киназыАнализ киназы AKT проводили в соответствии с инструкциями производителя (CycLex CY-1168, MBL, Япония). Вкратце, равные количества экстракта кератиноцитов добавляли в лунки планшета вместе с АТФ-содержащим киназным реакционным буфером. После 60 минут инкубации лунки промывали и затем инкубировали с антителом, конъюгированным с HRP, в течение дополнительных 60 минут. После промывания лунки инкубировали с реагентом субстрата в течение 10 минут. Наконец, добавляли стоп-раствор и измеряли оптическую плотность с использованием планшет-ридера при двух длинах волн 450/540 нм (модель BIO-RAD 680).
Вестерн-блоттинг (WB)1-см 2 образца эпидермиса получали, как описано для выделения РНК, лизировали в буфере RIPA и кипятили в буфере для образцов SDS. 30 мкг белка разделяли в гелях SDS-PAGE и переносили на нитроцеллюлозные мембраны (BIO-RAD). Мембраны инкубировали в течение ночи при 4 ° C с первичными антителами с последующей 1-часовой инкубацией при комнатной температуре с соответствующими вторичными антителами, конъюгированными с HRP (Santa Cruz Biotechnology). Иммунообнаружение было усилено реагентами для обнаружения хемилюминесценции (Thermo Scientific Pierce).Пленки сканировали на денситометре с калиброванным изображением GS710 и оптическую плотность полос измеряли с помощью программного обеспечения Quantity One версии 4.1.1 (BIO-RAD). Используемые антитела перечислены в таблице S2.
ИммунофлуоресценцияБиопсии кожи размером 1 см 2 вырезали 3dpd, заливали в криостатную среду Killik (Bio-Optica) и быстро замораживали. Срезы размером 5 мкм были разрезаны, обработаны, как описано [1], и инкубированы в течение ночи при 4 ° C с анти-TCL1 (крысиное моноклональное антитело 5A4 от Areta International), анти-фосфо-AKT (9271 Cell Signaling Technology), анти-cFOS (PC38 Calbiochem. -MERK), анти-cJUN (610326 BD biosciences), анти-фосфо-cJUN (3270 Cell Signaling Technology), анти-KRT6A (PRB-169P) или анти-KRT10 (PRB-159P Covance-Biolegend).Вторичные антитела, конъюгированные с FITC, CY3 или CY5, были получены от Jackson ImmunoResearch. Образцы наблюдали с помощью лазерной сканирующей конфокальной микроскопии с использованием микроскопа Zeiss LSM 510 Meta.
Анализ эффективности образования колоний (CFE)Свежевыделенные KCs низкой плотности высевали в 6-луночные планшеты (500 клеток / лунку в трех экземплярах) и культивировали в течение двух недель. Затем клетки фиксировали 2% параформальдегидом в течение 15 минут и окрашивали 1,5% родамином B в воде в течение 20 минут. Подсчитывали колонии и наносили на график среднее количество трех независимых экспериментов.Кроме того, для каждого пассажа рассчитывали процент от общего числа колоний, образовавшихся из Tcl1 – / -, по отношению к клеткам WT или K14-TCL1.
Анализ пролиферации.Криоконсервированные KC p0 высевали в колбу для культивирования клеток Т25. При пассаже p1 0,5 × 10 4 клетки высевали в 96-луночные планшеты в трех повторностях. Субконфлюэнтные клетки голодали в течение 16 часов в базальной среде Cnt-57 (CELLnTEC, Швейцария), а затем культивировали либо с 100 нг мл -1 рекомбинантного мышиного IGF-1 (Peprotech, Великобритания) в базальной среде, только в базовой среде или полная среда.Через 24 часа клетки фиксировали 3% формальдегидом в PBS, затем промывали и окрашивали 0,5% раствором кристаллического фиолетового в течение 30 минут при комнатной температуре. Образцы элюировали 100 мкл 0,1 М цитрата натрия в 50% этаноле, pH 4,2, и оптическую плотность (OD) измеряли при 595 нм с использованием считывающего устройства для микропланшетов BIO-RAD Model 680. Для каждой обработки различия в пролиферации клеток между тремя генотипы оценивали как отношение значений OD по сравнению с WT. Кроме того, влияние различных обработок на пролиферацию оценивалось для каждого генотипа как отношение OD полностью обработанного или обработанного IGF1 к базальному значению.
Статистический анализСтатистический анализ выполняли с использованием программного обеспечения GraphPad Prism 6. Для анализов CFE и пролиферации статистическую значимость определяли с помощью множественного Т-теста с использованием метода Холма-Сидака с альфа = 5.000%. Для анализа вестерн-блоттингом значимость рассчитывалась с помощью парного Т-теста. Эксперименты по экспрессии генов анализировали, как описано в параграфе «Профиль экспрессии микроматрицы» этого раздела.
Результаты Эпидермис мышей Tcl1 – / – демонстрирует дефектную передачу сигналов пролиферации и дифференцировки, что выявлено профилированием экспрессии генов (GEP). Геном 430 2.0 для генерации GEP эпидермальных KCs, полученных из моделей мышей WT, Tcl1 – / – и K14-TCL1 [1].
GEP KC K14-TCL1 больше похож на WT, чем на анализ главных компонентов (PCA) Tcl1 – / –трех групп с использованием программного обеспечения Partek, выявляет четко различимую кластеризацию между ними (рис. 1A), подтверждая главную роль для Tcl1a в эпидермисе. Более того, неконтролируемый иерархический кластерный анализ с использованием программного обеспечения BRB показывает, что GEP мышей, несущих трансген K14-TCL1, больше похож на WT, чем на Tcl1 – / – один (Рис. 1B).Контролируемый анализ сформировал список из 271 гена, дифференциально экспрессируемого между KC WT, Tcl1 – / – и K14-TCL1 (таблица S3, P <0,001). Сравнение двух выборок было также выполнено у мышей WT против Tcl1 - / -, WT против K14-TCL1 и Tcl1 - / - против мышей K14-TCL1 (таблицы S4 – S6, соответственно). Результаты экспериментов по экспрессии генов были подтверждены с помощью ПЦР в реальном времени для 10 генов, случайным образом выбранных среди наиболее регулируемых или недостаточно регулируемых (таблица S1).
10.1371 / journal.pone.0204775.g001 Рис.(A) PCA, проведенный Partek GS по совокупности генов, показывает, что образцы K14-TCL1 (TG, синие сферы), Tcl1 – / – (KO, красные сферы) и WT (зеленые сферы) остаются как три хорошо- отдельные группы. (B) Неконтролируемый иерархический анализ с помощью R наиболее значимых дифференциально экспрессируемых генов (31 ген, P <1e-07) показывает, что KC K14-TCL1 больше похожи на WT, чем на Tcl1 - / -. (C) Процент «спасенных» и «не спасенных» генов в KC K14-TCL1 среди 93 наиболее значимых и наиболее дифференциально экспрессируемых генов между Tcl1 - / - и KC WT.См. Текст для дальнейшего объяснения.
Чтобы оценить, в какой степени восстановление экспрессии TCL1A в базальных KCs способно спасти Tcl1 – / – GEP на уровне WT, мы выполнили общий анализ генов, перечисленных в таблице S3. Мы отнесли каждый ген к группе «спасенных» или «не спасенных» (рис. 1C) на основании следующих критериев: во-первых, мы ограничили анализ 93 генами с оценкой FDR ниже 1,00e-05 и кратным изменением. (FC) больше 1,5 или меньше 0.75 относительно отношения Tcl1 – / – к WT; во-вторых, на основе попарной значимости мы считали «спасенными» гены, которые существенно не различались между KC WT и K14-TCL1, указывая на то, что они были возвращены на физиологическом уровне, и «не спасли» гены, которые существенно не различались между Tcl1 – / – и K14-TCL1 (16 и 15 генов соответственно). Дополнительные 20 генов считались «спасенными», поскольку их экспрессия была возвращена в K14-TCL1 по сравнению с Tcl1 – / -, хотя и чрезмерно, по сравнению с WT, скорее всего, из-за сверхэкспрессии трансгена.Остальные 42 гена экспрессируются в KC K14-TCL1 на промежуточном уровне между WT и Tcl1 – / -. Среди них мы произвольно считали экспрессию генов K14-TCL1 KCs ’« достаточно »подобной WT, когда отношение к WT было ниже, чем отношение к Tcl1 – / -. В последнем столбце таблицы S3 указано отнесение каждого гена к соответствующей группе. Эти данные указывают на то, что потеря Tcl1a влияет на экспрессию нескольких генов в эпидермисе мыши и восстановление экспрессии TCL1A в базальном слое, чтобы спасти 55% этих генов (рис. 1C).
Онтология генов (GO) и анализ путей определяют функциональные и молекулярные дефекты в Tcl1 – / – KCsGO, а анализ путей был использован для исследования биологических механизмов, на которые может влиять потеря или усиление функции Tcl1a. GO анализ проводился с порогом значимости 0,005 для наборов генов. Среди терминов GO мы сосредоточились на тех, которые преобладают в наборах генов сверхэкспрессированных или недостаточно экспрессируемых генов (≥80%, серые отмечены в таблицах S7 – S9). Анализ показал, что мыши Tcl1 – / – дефектны по отношению к WT в дифференцировке кератиноцитов, развитии эпителия и компонентах цитоскелета, а также в процессе митоза.Напротив, гены, участвующие в процессинге антигена, сверхэкспрессируются у Tcl1 – / – по сравнению с WT (таблица S7). Интересно, что когда мышей K14-TCL1 сравнивают с WT, дефекты дифференцировки, развития и митоза больше не обнаруживаются. Избыточно представленные гены в основном участвуют в ответе на стимулы, организации актина и перемещении. Небольшое увеличение презентации антигена все еще наблюдается, даже если FC аннотированных генов все, кроме одного, ниже 1,15 (таблица S8). Сравнение мутантных и трансгенных мышей поразительно напоминало сравнение Tcl1 – / – и WT, за исключением подавления митоза (таблица S9).Путем анализа путей мы определили наборы генов, которые были значительно нарушены (P <0,05). Полные списки измененных путей у WT по сравнению с Tcl1 - / -, WT по сравнению с K14-TCL1 и Tcl1 - / - по сравнению с K14-TCL1 приведены в приложении (таблицы S10 – S12, соответственно). Сосредоточившись на тех, которые участвуют в регуляции пролиферации, дифференцировки и выживания, большинство измененных путей относятся к передаче сигналов факторов роста (IGF1, EGF, PDGF, NGF), с каскадом MAPK / AP1, который также участвует (таблицы 1, 2 и 3, соответственно) .
10.1371 / journal.pone.0204775.t001 Таблица 1| Биокарта Путь | Описание пути | Количество генов | LS перестановка p-значение | KS перестановка p-значение | Тест GSA Эфрона-Тибширани, p-значение |
|---|---|---|---|---|---|
| m_insulinPathway | Сигнальный путь инсулина | 10 | 0.00181 | 0,00356 | <0,005 (-) |
| m_tollpathway | Путь толл-подобного рецептора | 10 | 0,00335 | 0,04491 | <0,005 (-) |
| m_igf1Pathway | Сигнальный путь IGF-1 | 11 | 0,00414 | 0,02449 | <0,005 (-) |
| m_keratinocyte Путь | Дифференциация кератиноцитов | 19 | 0.00582 | 0,08422 | 0,155 (-) |
| m_pdgfPathway | Сигнальный путь PDGF | 13 | 0,00704 | 0,05368 | <0,005 (-) |
| m_ngfPathway | Путь фактора роста нервов (NGF) | 10 | 0,00824 | 0,00356 | <0,005 (-) |
| m_egfPathway | Сигнальный тракт EGF | 13 | 0.00901 | 0,15252 | <0,005 (-) |
| m_tnfr2Pathway | Сигнальный путь TNFR2 | 5 | 0,01526 | 0,12641 | 0,105 (-) |
| m_cdk5Pathway | Фосфорилирование MEK1 с помощью cdk5 / p35 подавляет путь киназы MAP | 5 | 0,01881 | 0,07774 | 0,255 (+) |
| m_cd40Pathway | Сигнальный путь CD40L | 5 | 0.01954 | 0,12641 | 0,105 (-) |
| m_dspPathway | Регулирование путей MAP-киназ с помощью фосфатаз двойной специфичности | 6 | 0,02606 | 0,4878 | 0,295 (+) |
| m_chemicalPathway | Апоптотическая передача сигналов в ответ на повреждение ДНК | 5 | 0,02607 | 0,20826 | 0,21 (-) |
| m_gleevecpathway | Ингибирование клеточной пролиферации с помощью Gleevec | 11 | 0.03291 | 0,12153 | <0,005 (-) |
| m_gpcrPathway | Сигнальный путь из семейств G-белков | 8 | 0,03294 | 0,35841 | 0,115 (-) |
| m_mcmPathway | Регуляция репликации ДНК CDK | 7 | 0,07259 | 0,16498 | <0,005 (+) |
| m_akap95Pathway | Роль AKAP95 в митозе и динамике хромосом | 5 | 0.10241 | 0,06738 | <0,005 (+) |
| m_rasPathway | Сигнальный тракт Ras | 5 | 0,19114 | 0,06091 | <0,005 (+) |
| m_g1Pathway | Цикл ячейки: G1 / S Check Point | 13 | 0,23224 | 0,01245 | 0,125 (+) |
| m_RacCycDPathway | Влияние белков Ras и Rho на переход от G1 к S | 7 | 0.27633 | 0,02567 | 0,335 (+) |
| Биокарта Путь | Описание пути | Количество генов | LS перестановка p-значение | KS перестановка p-значение | Тест GSA Эфрона-Тибширани, p-значение |
|---|---|---|---|---|---|
| m_akap95Pathway | Роль AKAP95 в митозе и динамике хромосом | 5 | 0.00419 | 0,02644 | <0,005 (+) |
| m_tollpathway | Путь толл-подобного рецептора | 10 | 0,00553 | 0,07202 | <0,005 (-) |
| m_chemicalPathway | Апоптотическая передача сигналов в ответ на повреждение ДНК | 5 | 0,00695 | 0,03123 | 0,135 (-) |
| m_egfPathway | Сигнальный тракт EGF | 13 | 0.00835 | 0,04904 | <0,005 (-) |
| m_cd40Pathway | Сигнальный путь CD40L | 5 | 0,01208 | 0,16315 | 0,065 (-) |
| m_tnfr2Pathway | Сигнальный путь TNFR2 | 5 | 0,01278 | 0,16315 | 0,23 (+) |
| m_pdgfPathway | Сигнальный путь PDGF | 13 | 0,01652 | 0.16707 | <0,005 (-) |
| m_dspPathway | Регулирование путей MAP-киназ с помощью фосфатаз двойной специфичности | 6 | 0,01716 | 0,12992 | 0,18 (-) |
| m_gleevecpathway | Ингибирование клеточной пролиферации с помощью Gleevec | 11 | 0,0199 | 0,16504 | <0,005 (-) |
| m_cdk5Pathway | Фосфорилирование MEK1 с помощью cdk5 / p35 подавляет путь киназы MAP | 5 | 0.02752 | 0,15282 | 0,455 (-) |
| m_gpcrPathway | Сигнальный путь из семейств G-белков | 8 | 0,03275 | 0,21625 | <0,005 (-) |
| m_g2Pathway | Цикл ячейки: контрольная точка G2 / M | 9 | 0,03701 | 0,04128 | 0,065 (+) |
| m_ngfPathway | Путь фактора роста нервов (NGF) | 10 | 0.05594 | 0,25037 | <0,005 (-) |
| m_atmPathway | Сигнальный тракт ATM | 10 | 0,15562 | 0,02225 | 0,105 (+) |
| m_igf1Pathway | Сигнальный путь IGF-1 | 11 | 0,23682 | 0,48638 | <0,005 (-) |
| m_fasPathway | Сигнальный путь FAS (CD95) | 8 | 0.25341 | 0,27857 | <0,005 (+) |
| m_tgfbPathway | Сигнальный путь бета-TGF | 7 | 0,43 | 0,09677 | <0,005 (+) |
| Биокарта Путь | Описание пути | Количество генов | LS перестановка p-значение | KS перестановка p-значение | Тест GSA Эфрона-Тибширани, p-значение |
|---|---|---|---|---|---|
| m_pdgfPathway | Сигнальный путь PDGF | 13 | 0.01738 | 0,06222 | 0,24 (-) |
| m_egfPathway | Сигнальный тракт EGF | 13 | 0,01881 | 0,06222 | 0,235 (-) |
| m_insulinPathway | Сигнальный путь инсулина | 10 | 0,04619 | 0,07895 | 0,14 (-) |
| m_igf1Pathway | Сигнальный путь IGF-1 | 11 | 0,05016 | 0.04466 | 0,21 (-) |
| m_wntPathway | Сигнальный тракт WNT | 8 | 0,06155 | 0,0295 | 0,05 (+) |
| m_g2Pathway | Цикл ячейки: контрольная точка G2 / M | 9 | 0,08182 | 0,01766 | 0,49 (+) |
| m_akap95Pathway | Роль AKAP95 в митозе и динамике хромосом | 5 | 0,0887 | 0.00149 | 0,47 (+) |
| m_cd40Pathway | Сигнальный путь CD40L | 5 | 0,11107 | 0,02473 | 0,14 (-) |
| m_aktPathway | Сигнальный тракт AKT | 6 | 0,19848 | 0,00206 | 0,06 (+) |
| m_erkPathway | Erk1 / Erk2 Mapk Сигнальный путь | 6 | 0,29669 | 0,04846 | 0.39 (+) |
Эти данные убедительно подтверждают с молекулярной точки зрения функциональные дефекты, наблюдаемые в Tcl1 – / – и устраненные у мышей K14-TCL1 in vivo [1], и указывают на фактор роста и передачу сигналов MAPK среди основных молекулярная дерегуляция из-за потери Tcl1a.
Потеря Tcl1a влияет на количество клеток-предшественников и скорость пролиферации кератиноцитов мышейРанее мы обнаружили отсутствие пролиферирующих клеток TA и прогрессирующую потерю SCs CD34 + в волосяных фолликулах [1].Воспользовавшись данными об экспрессии генов, описанными выше, мы исследовали количество клеток-предшественников в первичных KCs, выделенных от Tcl1 – / – и от мышей K14-TCL1, по сравнению с WT, с помощью анализа колониеобразующей эффективности (CFE) (рис. 2A). Вскоре после выделения (p0) Tcl1 – / – KCs дали 49% +/- 18 и 58% +/- 22 общего числа колоний по сравнению с клетками WT и K14-TCL1, соответственно, хотя эти различия не были значительными. Различия стали заметными при первом пассаже (p1), поскольку колонии Tcl1 – / – стали 12% +/- 5 и 15% +/- 7 WT и K14-TCL1, соответственно.В самом деле, Tcl1 – / – KCs не показали никаких изменений в их CFE или имели небольшие изменения, в то время как WT и K14-TCL1 показали свой пик. На p2 разница в CFE между TCL1-нулевыми и TCL1-экспрессирующими клетками была уменьшена, но все еще значима (34% +/- 6 и 25% +/- 4 WT и K14-TCL1, соответственно). После этого значения CFE для трех разных типов клеток стремятся к 0 аналогичным образом (анализ CFE проводился до p10, не показано).
10.1371 / journal.pone.0204775.g002 Рис.(A) Анализ CFE, проведенный на первых трех пассажах KC WT (кружки), Tcl1 – / – (квадраты) и K14-TCL1; Tcl1 – / – (треугольники вниз) мыши; значения выражены как общее количество колоний; CFE WT и K14-TCL1 значительно различаются по отношению к Tcl1 – / – на пассажах p1 и p2 (* P <0,001; ** P <0,005). (B) Пролиферация в культивируемых KC от мышей WT (темно-серый), Tcl1 - / - (черный) или K14-TCL1 (светло-серый). KC на пассаже p1 культивировали в основной среде, в полной среде или в основной среде плюс 100 нг мл -1 IGF-1; Приведены значения OD.Все эксперименты проводили в трех экземплярах. Отмечены достоверные различия в росте между группами (* P <0,001; ** P <0,005).
Кроме того, мы проанализировали скорость роста KC в трех генотипах (рис. 2B). При пассаже p1 KC культивировали в основной или полной среде в течение 24 часов. В базальной среде клетки мышей Tcl1 – / – росли меньше, чем клетки дикого типа (изменение 0,53 +/- 0,02 раз, P <0,005), тогда как в клетках K14-TCL1 дефект был менее серьезным (0,73 + / -0,18 -кратное изменение, незначительное).При культивировании KC в полной среде скорость пролиферации клеток WT увеличивалась примерно в два раза, как и у клеток K14-TCL1 (1,92 +/- 0,13 – и 2,18 +/- 0,14 -кратное изменение соответственно), в то время как Tcl1- / – клетки показали значительно меньшее увеличение (1,31 +/- 0,17 -кратное изменение) (фиг. 2B). Наши данные GEP показали, что путь IGF1 является одним из наиболее измененных у мышей Tcl1 – / – по сравнению с WT (Таблица 1). Поскольку известно, что IGF1 регулирует эпидермальную пролиферацию [29, 30], мы протестировали его способность стимулировать KC в отношении базального состояния среды.Мы обнаружили аналогичный прирост пролиферации в клетках WT и K14-TCL1 (1,62 +/- 0,06 – и 1,4 +/- 0,07 -кратное изменение, соответственно), в то время как Tcl1 – / – клетки полностью не реагировали (1,04 + / -0.02 -кратное изменение).
Взятые вместе, эти результаты подтверждают важную роль TCL1 в поддержании клеток-предшественников KC и его потребность в качестве фактора пролиферации, особенно при действии через путь IGF1.
Экспрессия маркеров дифференцировки изменена в моделях мышей Tcl1a. Наш анализ GO показал, что модуляция экспрессии Tcl1a имеет последствия для дифференцировки KCs.Следовательно, мы исследовали паттерн экспрессии маркеров дифференцировки, которые идентифицируют верхние эпидермальные слои (остистые и гранулярные) (рис. 3A – 3C). Цитокератин 6 (KRT6) считается маркером активации KC [31, 32] и является одним из наиболее дифференциально экспрессируемых генов в нашем GEP-анализе (таблицы S3 – S6). Соответственно, иммунофлуоресценция KRT6 в образцах кожи через 3 дня после депиляции (3dpd) показывает локализованную экспрессию в эпидермисе, окружающем волосяные фолликулы у мышей WT, в то время как только несколько разбросанных клеток экспрессируют KRT6 у мышей Tcl1 – / -.Интересно, что мыши K14-TCL1 демонстрируют сильную и диффузную иммунореактивность KRT6 во всем эпидермисе (рис. 3A). WB-анализ образцов эпидермального слоя 3dpd подтвердил, что экспрессия KRT6 резко снижается у мышей Tcl1 – / – и сильно сверхэкспрессируется в K14-TCL1 по сравнению с мышами WT (изменение в 0,36 и 8 раз, соответственно, фиг. 3C). Цитокератин 10 (KRT10) является одним из первых маркеров дифференцировки, который экспрессируется постмитотическими клетками в остистом слое, и он играет роль в контроле пролиферации [33].Иммунофлуоресценция подтвердила надбазальную экспрессию KRT10 во всех трех генотипах (рис. 3В). В этом случае анализ WB показал, что у мышей Tcl1 – / – и K14-TCL1 наблюдается более чем 2-кратное изменение экспрессии KRT10 по сравнению с мышами WT (2,8 и 2,2 раза, соответственно) (рис. 3C). FLG и IVL являются маркерами терминальной дифференцировки гранулярного слоя, но регулируются противоположным образом в моделях мышей Tcl1a. Эксперименты WB показали, что FLG более экспрессируется у мышей K14-TCL1 (в 3 раза) и меньше у мышей Tcl1 – / – (0.В 4 раза) по сравнению с WT; Напротив, ИВЛ увеличивается в Tcl1 – / – KCs (в 4 раза), тогда как она почти не обнаруживается у K14-TCL1 (в 0,12 раза) (Рис. 3C). В целом, эти данные демонстрируют, что TCL1 глубоко вовлечен в регуляцию как ранних, так и конечных программ дифференцировки KC.
10.1371 / journal.pone.0204775.g003 Рис.Иммунофлуоресценция для маркера активации KRT6 (зеленый) (A) или маркера дифференцировки KRT10 (зеленый) (B) на эпидермисе мышей WT, Tcl1 – / – и K14-TCL1.Ядерный контраст – йодид пропидия (красный). Увеличение: 40X. Изображения получали конфокальным лазерным сканированием. Показаны репрезентативные изображения трех экспериментов. (C) Вестерн-блот-анализ белковых экстрактов эпидермального слоя мышей WT, K14-TCL1 (K14) и Tcl1 – / – (- / -) на маркеры дифференцировки. Результаты рассчитывали как кратное изменение значений K14-TCL1 или Tcl1 – / – по отношению к значениям OD WT. Образцы также анализировали на маркеры апоптоза PARP1 и CASP3 (D). C-PARP1 и C-CASP3 представляют собой расщепленные формы.Результаты рассчитывали как процентное соотношение расщепленной формы к сумме расщепленных и полных нормализованных значений OD.
Наконец, мы ранее наблюдали, что базальные KCs в эпидермисе Tcl1 – / – мышей аберрантно коэкспрессируют маркеры пролиферации и апоптоза in vivo [1]. Более того, существуют доказательства антиапоптотического эффекта TCL1 за счет уменьшения расщепления PARP1 у людей [25]. В соответствии с этой функцией, в экспериментах WB на эпидермисе 3dpd мы обнаружили, что процент расщепления PARP1 у Tcl1 – / – выше, чем у WT (63% и 35% соответственно), тогда как у K14-TCL1 он сопоставим с WT. (38%) (Рис. 3D).Аналогичные результаты были получены при анализе расщепления каспазой 3 (69%, 33% и 37% соответственно). Следовательно, эти эксперименты подтверждают антиапоптотическую роль TCL1 в мышиных KCs.
Модуляция TCL1 влияет на уровни фосфорилирования ERK1 / 2, SAPK / JNK и P38 MAPKВ отличие от функции TCL1 в иммунной системе [22], когда мы проанализировали активацию AKT в мутантных и трансгенных KC с помощью киназного анализа, мы не обнаружили существенных различия по отношению к WT (панель A на фиг. S1). В соответствии с этим результатом, фосфорилированный AKT (Ser473) не локализуется совместно с TCL1 в фолликулярных кератиноцитах дикого типа, проанализированных с помощью иммунофлуоресценции (панель B на S1 фиг.).Более того, анализ путей не указал на передачу сигналов AKT среди тех, на которые влияет модуляция TCL1. Скорее, наши данные GEP подчеркнули участие MAPKs в ответ на модуляцию Tcl1a. Каскад MAPK играет центральную роль в регуляции дифференцировки и запрограммированной гибели клеток в эпидермисе посредством фосфорилирования ERK1 / 2, SAPK / JNK и P38 [34].
Таким образом, мы исследовали с помощью анализа WB скорость фосфорилирования ERK1 / 2, SAPK / JNK и P38 MAPK в KC от мышей Tcl1 – / – и K14-TCL1 по сравнению с образцами WT (рис. 4).Мы обнаружили, что потеря Tcl1a увеличивает скорость фосфорилирования P38 по сравнению с мышами WT и K14-TCL1 в 7,2 и 2,8 раза соответственно (рис. 4A и 4C). Напротив, сверхэкспрессия TCL1A индуцировала 32-кратное увеличение ERK1 / 2 (фиг. 4A-4C) и 2,6-кратное увеличение фосфорилирования SAPK / JNK (фиг. 4B и 4C) по сравнению с WT. Нормализованные значения оптической плотности (OD) фосфорилированной и целой форм приведены в приложении (панели A, B и C на фиг. S2). График на фиг. 4C показывает скорость фосфорилирования для этих белков, рассчитанную как отношение OD фосфорилированной формы ко всей форме.Эти результаты показывают, что в отсутствие Tcl1a маршрут P38 гиперактивируется, оставляя нетронутыми передачу сигналов ERK1 / 2 и SAPK / JNK. С другой стороны, сверхэкспрессия TCL1A в базальных KC частично восстанавливает фосфорилирование P38 до уровней WT и усиливает активацию ERK1 / 2 и SAPK / JNK.
10.1371 / journal.pone.0204775.g004 Рис.Вестерн-блоттинг фосфорилированных форм P38, ERK1 / 2 (A) и SAPK / JNK MAPK (B) на экстрактах белков из кератиноцитов мышей WT, Tcl1 – / – и K14-TCL1.Тубулин альфа (αTUB) использовали для нормализации белковой нагрузки. (C) Нормализованные значения OD использовались для расчета отношения фосфорилированных форм к целым и отображались как среднее и стандартное отклонение трех независимых экспериментов для WT (темно-серый), Tcl1 – / – (светло-серый) и K14-TCL1 ( черный) KCs.
Транскрипционный комплекс активаторный белок 1 (AP1) представляет собой один из основных эффекторов сигнального каскада MAPK в эпидермисе [34, 35].Поскольку наши данные GEP показывают увеличение мРНК cFos в 8,4 раза у мышей Tcl1 – / – по сравнению с WT (таблица S4), мы исследовали изменения в основных субъединицах AP1 cFOS и cJUN.
Мы проанализировали белок cFOS конфокальным анализом на образцах кожи 3dpd трех генотипов (рис. 5A). Первое свидетельство состоит в том, что согласно данным мРНК, экспрессия cFOS усиливается в Tcl1 – / – по сравнению с WT, также на уровне белка, и лишь частично восстанавливается у мышей K14-TCL1. Интересно, что мы также обнаружили, что в коже WT клеточная локализация cFOS полностью ограничена цитоплазматическим компартментом базального слоя.На панели WT на фиг. 5A зеленая флуоресценция, представляющая окрашивание cFOS, сосредоточена вокруг синей флуоресценции ядер. Напротив, в отсутствие Tcl1a cFOS сильно локализован в ядерном компартменте клетки, что визуализируется как голубая флуоресценция на фиг. 5A. В панели K14-TCL1 картина окрашивания cFOS занимает промежуточное положение между образцами WT и Tcl1 – / -. Эти данные предполагают, что TCL1-опосредованное ингибирование транскрипционной активности cFOS, происходящее в человеческом B-CLL [25], может также функционировать в мышиных KCs.Когда мы проанализировали экспрессию cJUN в коже трех моделей мышей, мы наблюдали сопоставимые уровни общего белка cJUN, который был ограничен цитоплазмой базальных KC во всех образцах (рис. 5B). Напротив, фосфорилирование cJUN было связано с ядерной локализацией, и было обнаружено, что количество положительных клеток снижается в Tcl1 – / – и увеличивается в KCs K14-TCL1 по сравнению с аналогом WT. Чтобы подтвердить и количественно оценить эту разницу, мы проанализировали скорость фосфорилирования cJUN с помощью WB и нашли 0.Снижение фосфорилирования cJUN в Tcl1 – / – KCs в 7 раз по сравнению с WT (фиг. 5C и 5D). В то же время сверхэкспрессия TCL1A приводит к увеличению скорости фосфорилирования cJUN в 1,9 и 1,3 раза по сравнению с Tcl1 – / – и WT, соответственно. Нормализованные значения OD фосфорилированной и полной форм приведены в приложении (панель D на фиг. S2). Эти эксперименты показывают, что TCL1 принимает участие в регуляции AP1, контролируя как локализацию cFOS, так и фосфорилирование cJUN.
10.1371 / журнал.pone.0204775.g005 Рис.(A) Иммунофлуоресценция cFOS (зеленый) или (B) cJUN (красный) и фосфо-cJUN (зеленый) на эпидермисе мышей WT, Tcl1 – / – и K14-TCL1. Ядерный контраст – йодид пропидия (синий). Слияние зеленой и синей флуоресценции представляет собой ядерную локализацию (голубой). Увеличение: 40X. Изображения получали конфокальным лазерным сканированием. (C) Вестерн-блоттинг cJUN и фосфо-cJUN на белковых экстрактах KC от мышей WT, Tcl1 – / – и K14-TCL1.(D) Нормализованные значения OD использовались для расчета отношения фосфорилированной формы ко всей форме и графически отображены как среднее и стандартное отклонение трех независимых экспериментов для WT (темно-серый), Tcl1 – / – (светло-серый) и K14-TCL1 ( черные) мыши.
Ранее мы показали, что у взрослых мышей Tcl1 – / – развиваются дефекты кожи из-за резкого снижения маркера стволовых клеток CD34 и пролиферирующих ТА-клеток в волосяном фолликуле, а также из-за дисрегуляции программы пролиферации / дифференцировки / апоптоза в межфолликулярном эпидермисе [1] .В этой работе мы наконец продемонстрировали, что Tcl1a необходим для правильного программирования и активации эпидермальных KC.
Анализ GEP показывает, что потеря Tcl1a вызывает глубокое нарушение регуляции экспрессии генов в эпидермальной ткани. Кроме того, модель мыши, несущая управляемый K14 ген TCL1A на нулевом фоне Tcl1a, больше похожа на WT, чем на Tcl1 – / -, поэтому дает первое общее статистическое подтверждение ранее наблюдаемой способности трансгенного K14-TCL1 мыши, чтобы спасти мутантный фенотип Tcl1 – / -.В частности, экспрессия 55% генов с нарушенной регуляцией в Tcl1 – / – восстанавливается в KCs K14-TCL1. Среди них 36 генов (39%) полностью спасены на физиологическом уровне или отменены, что указывает на тесную связь с TCL1. Интересно, что 29 из этих 36 генов подавлялись в Tcl1 – / – KCs, подтверждая роль TCL1 как активатора транскрипции [25] также в эпидермальных клетках. С другой стороны, мышь K14-TCL1 не способна спасти все гены, на которые влияет отсутствие Tcl1a, особенно те, которые сверхэкспрессируются, указывая тем самым, что присутствие Tcl1a необходимо, но недостаточно для этих факторов.Другая возможность состоит в том, что TCL1A, управляемый K14, неспособен регулировать факторы, действующие в надбазальных слоях, из-за того, что его экспрессия ограничена базальным слоем.
На функциональном уровне анализ GO указал на дифференцировку и деление клеток как на две функции, дефектные в Tcl1 – / – KCs, которые восстанавливаются в K14-TCL1. В отличие от T- и B-клеточных трансгенных моделей TCL1A, сверхэкспрессия в эпидермальных KCs не вызывала гиперпролиферации, и мы не наблюдали образование опухолей кожи у мышей K14-TCL1 [1].Этот фенотип согласуется с нашими данными GEP и анализом GO и может быть связан с более мягкой активностью промотора K14 по сравнению с lck или Eμ. Альтернативно, программы пролиферации / выживания в KC могут подвергаться жесткому контролю, способному преодолеть сверхэкспрессию TCL1A. Скорее, чрезмерно представленные гены относятся к ответу на стимул и условиям клеточной подвижности GO без каких-либо доказательств какого-либо аберрантного фенотипа.
Krt6 – один из наиболее значимых дифференциально экспрессируемых генов, обнаруженных с помощью нашего анализа GEP.Krt6 конститутивно не экспрессируется в коже, но быстро индуцируется после повреждения эпидермиса (например, восковой депиляции) и считается маркером активации KCs как для пролиферации, так и для дифференцировки [31, 32]. Интересно, что мы наблюдали, что в эпидермисе 3dpd WT белок KRT6 в основном экспрессируется базальными клетками и сохраняется в некоторых надбазальных клетках; в Tcl1 – / – эпидермисе экспрессия KRT6 резко снижена, а в K14-TCL1 KRT6 высоко экспрессируется во всех слоях. Таким образом, экспрессия KRT6 сильно зависит от регуляции TCL1, индуцируется в базальном слое и поддерживается в надбазальных слоях, указывая тем самым, что KRT6 может быть хорошим кандидатом, по крайней мере частично, для наблюдаемых дифференцированных и / или пролиферативных фенотипов.Напротив, надбазальный маркер KRT10 повышен у Tcl1 – / -, а также у мышей K14-TCL1 по сравнению с WT, что позволяет проиллюстрировать вышеупомянутые сверхэкспрессируемые «несохраненные» гены. Тем не менее, экспрессия маркеров терминальной дифференцировки FLG и IVL изменяется в Tcl1 – / -, но сохраняется у мышей K14-TCL1, указывая тем самым, что в надбазальных KCs некоторые программы дифференцировки могут быть активированы из базального слоя. Передача сигналов апоптоза представляет собой еще один интересный пример базальной / надбазальной стратификации, на которую влияет потеря Tcl1a.В нашей предыдущей работе мы наблюдали пролиферативный маркер, сосуществующий с апоптотическими событиями в базальном слое Tcl1 – / – мышей, хотя запрограммированная гибель клеток обычно активируется только в терминально дифференцированном слое. Эта аберрация была устранена за счет управляемой K14 сверхэкспрессии TCL1A [1]. Здесь мы показали, что апоптотические факторы PARP1 и CASP3 аномально активируются в Tcl1 – / – KC по отношению к WT, и экспрессия K14-TCL1 достаточна для восстановления физиологических уровней активации, напоминая антиапоптотический эффект TCL1, наблюдаемый при ХЛЛ человека [ 25].
Пролиферация – еще одна дефектная функция, которую мы описали в Tcl1 – / – скине [1], на что также было указано в этой работе анализом GO. Соответственно, первичные KC от мышей Tcl1 – / – почти неспособны образовывать колонии или пролиферировать при помещении в полную среду. С другой стороны, этот фенотип полностью устраняется, когда TCL1A повторно вставляется в базальные клетки мыши K14-TCL1, имитируя поведение WT. Эти эксперименты подтвердили, что сверхэкспрессия TCL1A не вызывает гиперпролиферации KC.Анализ путей идентифицировал фактор роста и MAPK как одни из наиболее значимых путей, измененных в Tcl1 – / – KCs. Поскольку известно, что IGF1 регулирует эпидермальную пролиферацию, подвижность и поведение клеток-предшественников, действуя через пути MAPK-AP1 и / или PI3K-AKT [29, 30, 36, 37], мы сосредоточились на IGF1-индуцированной пролиферации. Интересно, что мы обнаружили образец пролиферации, очень похожий на тот, который был получен при стимуляции сывороткой, с нарушенной пролиферацией Tcl1 – / – KCs, которая в значительной степени компенсировалась экспрессией K14-TCL1.Это открытие демонстрирует, что ген Tcl1a определенно необходим для пролиферации KCs как путем индукции сыворотки, так и IGF1.
На самом деле, несмотря на то, что наиболее известной функцией TCL1 является усиление активности киназы AKT [21, 23], мы не обнаружили каких-либо различий в активности киназы AKT между тремя моделями мышей. Это открытие согласуется с моделью двухклеточного эмбриона, которая не показала различий между содержанием фосфорилированного AKT у Tcl1 – / – и мышей WT [20]. Noguchi et al. предположили, что активность киназы AKT, поддерживаемая у Tcl1a нулевых мышей, может быть частично связана с присутствием пяти белков семейства TCL1B и MTCP1 в геноме мыши [38].Соответственно, мы сообщили о высоком уровне экспрессии изоформы Tcl1B2 в эпидермисе мышей, особенно в Tcl1 – / – one [1].
Что касается IGF1, большинство входящих сигналов, которые регулируют пролиферацию, дифференцировку и апоптоз в межфолликулярном эпидермисе, проходят через три основных каскада MAPK: ERK1 / 2, SAPK / JNK и P38 с несколькими взаимосвязями между каскадами [39]. Активация ERK1 / 2 в первую очередь опосредует сигналы пролиферации и выживания от ряда различных поверхностных молекул, включая факторы роста и белки клеточной адгезии; с другой стороны, P38 MAPK-зависимые механизмы в основном участвуют в регуляции процессов дифференцировки и апоптоза [34, 40–43].SAPK / JNK способен регулировать пролиферацию, дифференцировку, выживание и / или миграцию, таким образом настраивая различные процессы, такие как гомеостаз тканей, клеточный метаболизм, воспаление и канцерогенез [44]. Относительные активности MAPKs можно оценить по скорости их фосфорилирования, и здесь мы приводим доказательства того, что Tcl1 – / – мыши обнаруживает гиперактивацию P38 MAPK, которая может быть ответственна за наблюдаемый апоптотический фенотип. Кроме того, гиперфосфорилирование P38 может объяснять дифференциальные расстройства, такие как сверхэкспрессия IVL [45].Напротив, сверхэкспрессия TCL1A с помощью трансгена, управляемого K14, увеличивает фосфорилирование ERK1 / 2 и SAPK / JNK. То, что TCL1 может влиять на фосфорилирование ERK1 / 2, наблюдалось также в B-CLL, где нацеленная на TCL1 микроРНК-181b также снижала фосфо-ERK1 / 2 [46]. Таким образом, TCL1 может действовать как фактор пролиферации / выживания и регулятор дифференцировки, увеличивая фосфорилирование ERK1 / 2 и SAPK / JNK и поддерживая низкие уровни фосфо-P38.
В эпидермальных KCs нижестоящие мишени передачи сигналов MAPK в основном представлены фактором транскрипции AP1, который состоит из гомо- или гетеродимеров, в основном принадлежащих к семействам белков FOS и JUN.MAPK могут влиять на активность AP1 как путем прямого фосфорилирования, так и путем активации транскрипции промоторов конкретных компонентов AP1. Множественные члены семейства AP1 экспрессируются в эпидермисе и образуют разные пары димеров, регулируя экспрессию нескольких генов-мишеней и контролируя функции KC [45, 47, 48]. Не случайно с помощью чип-анализа мы обнаружили среди наиболее дисрегулируемых генов несколько факторов, участвующих в передаче сигналов MAPK, и, в частности, эффекторный cFos AP1.Тем не менее, TCL1, как сообщается, напрямую связывает cFOS, таким образом ингибируя апоптоз [25, 49]. Наши данные согласуются с этим наблюдением, и мы можем предположить, что TCL1 предотвращает транскрипционную функцию cFOS, секвестируя этот фактор в цитоплазму, имея cFOS в основном ядерную локализацию в Tcl1 – / – эпидермальных KCs. Этот фенотип устранен, хотя и не полностью, у мышей K14-TCL1. Более того, мы показали, что фосфорилирование cJUN снижается в отсутствие Tcl1a и увеличивается, когда TCL1A повторно вводится в KC.Следовательно, у мышиных KCs TCL1, по-видимому, оказывает стимулирующее, а не ингибирующее действие на активность cJUN, что было замечено в B-CLL Pekarsky et al. [25]. Это согласуется с ролью cJUN в пролиферации, дифференцировке и заживлении ран в эпидермальных клетках мышей [50-52].
.
 Обычно 1% всех волос находятся в фазе катагенеза.
Обычно 1% всех волос находятся в фазе катагенеза. В последнем триместре у беременных можно наблюдать либо алопецию лобно-височной области,
В последнем триместре у беременных можно наблюдать либо алопецию лобно-височной области,
 Увеличение количества телогеновых волос до 20% считают неблагоприятным показателем.
Увеличение количества телогеновых волос до 20% считают неблагоприятным показателем.  Выпадение более 6 волос свидетельствует о повышенной ломкости волос.
Выпадение более 6 волос свидетельствует о повышенной ломкости волос.
 Новый метод лечения выпадения волос,
Новый метод лечения выпадения волос,